ПЛАН КОНСПЕКТА открытого УРОКА
Подготовила учитель химии Ахмедова З.С.
Тип урока: изучение нового материала
Цели урока:
Обучающие:
познакомить учащихся с историей открытия алюминия, изучить физические свойства и применения железа;
познакомить учащихся со строением и химическими свойствами железа.
Развивающие:
развивать умения обобщать,
обращении к жизненному опыту школьников;
развивать речь, творческие и интеллектуальные способности учащихся, самостоятельность.
Воспитательные:
воспитать у учащихся наблюдательность, внимание, пытливость, инициативу и культуру эксперимента.
Оборудование и материалы:
- персональный компьютер и мультимедийные средства;
- таблицы «Периодическая система химических элементов» и «Растворимость кислот, солей и оснований»;
- на столах у учеников химическое оборудование: по 2 пробирки, хлорид железа (II), хлорид железа (III), роданид калия);
- карточки для составления плана урока: местоположение Fe в Периодической системе, строение атома, физические свойства, химические свойства, - - дидактический материал (тест и вопросы
Структура урока:
1. Организационный момент
2. Введение в новую тему
3. Изучение нового:
Железо как химический элемент
- Положение в ПС;
- Строение атома;
- Нахождение в природе
Железо простое вещество
- История открытия и получения железа
- Физические свойства железа;
- Химические свойства железа ;
- Получение железа
- Биологическая роль железа
4. Закрепление полученных знаний
5. Домашнее задание
6.. Рефлексия
Ход урока.
1.Организационный момент.
2. Введение в новую тему
Оно варилось в доменной печи,
Чтобы потом нам сделать
Ножницы, ключи.
Ответ: Железо
Иду в воду – красен,
Выйду – черен.
Ответ: Железо
Тема урока: Железо
3.Изучение нового.
I. Характеристика химического элемента
Вставьте пропущенные слова
1. Железо - элемент … периода, … группы, … подгруппы.
2. Заряд ядра атома железа равен +.
3. В ядре атома железа… протонов, … нейтронов.
4. В атоме железо… электронов.
5. Электронное строение железа…
6. На внешнем уровне в атоме железа … электронов.
7. Степень окисления атомов железа равна … .
8. Простое вещество железо является ….
9. Формула оксидов железа …, их характер ….
ИСТОРИЯ открытия железа
Было время, когда железо на земле ценилось значительно дороже золота. Советский историк Г. Арешян изучал влияние железа на древнюю культуру стран Средиземноморья.
Он приводит такую пропорцию: 1:160 : 1280 : 6400. Это соотношение стоимостей меди, серебра, золота и железа у древних хеттов. Как свидетельствует в «Одиссее» Гомер, победителя игр, устроенных Ахиллесом, награждали куском золота и куском железа.
Железо было в равной степени необходимо и воину, и пахарю, а практическая потребность, как известно,— лучший двигатель производства и технического прогресса.
Термин «железный век» введен в науку в середине XIX в. датским археологом К. Ю. Томсеном. «Официальные» границы этого периода человеческой истории: от IX—VII вв. до н. э. когда у многих народов и племен Европы и Азии начала развиваться металлургия железа, и до времени возникновения у этих племен классового общества и государства. Но если эпохи называть по главному материалу орудий труда, то, очевидно, железный век продолжается и сегодня.
Как получали железо наши далекие предки? Сначала так называемым сыродутным методом. Сыродутные печи устраивали прямо на земле, обычно на склонах оврагов и канав. Они имели вид трубы. Эту трубу заполняли древесным углем и железной рудой. Уголь зажигали, и ветер, дувший в склон оврага, поддерживал горение угля.
Железная руда восстанавливалась, и получалась мягкая крица —железо с включениями шлака. Такое железо называют сварочным; в нем содержалось немного углерода и примесей, перешедших из руды. Крицу ковали, куски шлака отваливались, и под молотом оставалось железо, пронизанное шлаковыми нитями. Из него отковывали различные орудия.
Век сварочного железа был долгим, однако людям древности и раннего средневековья было знакомо и другое железо. Знаменитую дамасскую сталь (или булат) делали на Востоке еще во времена Аристотеля (IV в. до н. э.). Но технология ее производства, так же как процесс изготовления булатных клинков, много веков держалась в секрете.
Физические свойства: . Физические свойства железа
Железо - серебристо-белый или серый металл, твердый, с высокой пластичностью, Железо как элемент образуется множество соединений, проявляя обычно степени окисления +2,+3. Железо – элемент побочной подгруппы VIII группы 4-го большого периода. Железо в соединениях проявляет степени окисления +2 и +3.
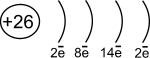 1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
Металл средней активности, восстановитель.
Железо является вторым по распространенности металлом в природе (после алюминия).
теплопроводностью и электропроводностью, плотность его равна 7,87 г/см3, тугоплавкий-1540 С0. В отличие от других металлов, железо способно намагничиваться.
При обычной температуре железо не взаимодействует даже с сильными окислит
Химические свойства железа:
Железо — металл с умеренной химической активностью.
елями, но при нагревании его активность повышается.
Железо взаимодействует при нагревании с простыми веществами:
кислородом
3Fe+2O2−→−tFe3O4(FeO⋅Fe2O3);
галогенами
2Fe+3Cl2−→−t2FeCl3;
серой
Fe+S−→−tFeS.
При обычных условиях железо не реагирует с водой и растворами щелочей.
Концентрированные растворы азотной и серной кислот пассивируют поверхность железа, и оно в них не растворяется.
При высокой температуре раскалённое железо реагирует с парами воды:
3Fe+4H2O−→−tFe3O4+4H2↑⏐⏐.
При растворении железа в кислотах могут образовываться соли железа(II) и железа(III).
Обрати внимание!
Если в результате реакции взаимодействия железа с раствором кислоты выделяется водород, то образуется соль двухвалентного железа:
Fe+2HCl=FeCl2+H2↑;
Fe+H2SO4=FeSO4+H2↑.
Железо вытесняет малоактивные металлы из растворов их солей:
Fe+CuSO4=FeSO4+Cu↓.
ВЫВОД:
Железо реагирует с HCl, проявляя при этом … … … химические свойства. Но железо реагирует и с KOH, проявляя … … …химические свойства. Следовательно, железо проявляет … … …химические свойства.
4. Закрепление полученных знаний:
1. Напишите уравнения реакций взаимодействия железа с простыми
веществами: кислородом, хлором, серой, бромом. Дайте названия
образующимся веществам.
2. Изобразите схему строения атома железа. Укажите степени окисления,
которые железо проявляет в соединениях.
3. Напишите уравнения реакций, при помощи которых можно осуществить
следующие превращения:
Fе (NOз)з→ Fе (ОН)з→ Fе 2O3 →Fе →FеС12
4. Какие свойства: окислительные или восстановительные —
проявляют соединения железа со степенью окисления + 2? Почему?
5.Домашнее задание : п.14 стр 63-65., индивидуальные задания:
- Советы при выполнении индивидуального выбора задания.
1. Внимательно прочти все задания.
2. Соотнеси своё желание в получении хорошей отметки с собственными возможностями правильного выполнения задания.
3. Выбирай и решай!
Задания
Часть А. на “3”
Fe+ Br2 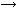
Fe + H2SO4 (p-p) 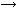
Часть В. на “4”
Fe 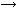 Fe 2O3
Fe 2O3 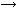 Fe Cl3
Fe Cl3
Fe  FeCl3
FeCl3  Fe2(SO4)3
Fe2(SO4)3
Часть С. на “5”
Что является веществом Х в реакциях:
Fе → X → Fе (ОН)2
Fе (ОН)2 → X →FеС1з
.
6. Рефлексия








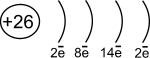 1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2