МКОУ «Джазаторская СОШ им. М.И. Берсимбаева»
Урок
по теме : «Фенолы»
10 класс (базовый уровень)
Подготовила и провела
учитель химии
Мандыканова Р. Е.
Джазатор 2014
Цель урока : Изучить состав, строение, свойства фенола.
Образовательные задачи:
изучить состав, строение, свойства фенола и его соединений
на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства
познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы
рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Развивающие задачи:
совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения
продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении химического эксперимента
Воспитательные задачи:
продолжить формирование химической картины мира через химическую картину природы (познаваемость, управление химическими процессами)
расширить представление учащихся о влиянии фенолсодержащих промышленных отходов и строительных материалов на окружающую среду и здоровье человека
рассмотреть биологическую роль фенола и его соединений на организм человека (положительную и отрицательную)
Ход урока:
1. Оргмомент
2. Изучение нового материала
Каждый из вас хотя бы один раз в жизни посещал музей живописи, на урок сегодня я принесла картины, которые изготовили учащиеся нашей школы. Как вы думаете какая связь между живописью и химией?
- краски
Действительно, ни одна картина не обходится без красок. Каждый из нас хотя бы раз в жизни брал краски и кисть. а вы никогда не задумывались над тем какие вещества входят в состав красок? с одним из удивительных веществ мы познакомимся на уроке, а так же с его составом, строением, свойствами.
Откройте тетради, запишите тему урока: «Фенолы», и подробно мы с вами познакомимся с представителем этого класса фенол.
Сообщение учащегося:
«История открытия фенола»
- это вещество было открыто в 1771 году. Сразу после открытия его стали использовать в качестве красителя. Текстильщики красили им свои ткани. В 1834 году немецкий химик органик Фридлиб Рунге обнаружил в продуктах перегонки каменно угольной смолы белое кристаллическое вещество с характерным запахом. ему не удалось определить состав вещества и установить её формулу и это сделал лишь в 1842 году Огюст Лоран. Вещество обладало кислотными свойствами и было производным открытого незадолго до этого бензола. Лоран назвал его бензол феном, и новая кислота получила название фениловой. Шарль Жерар считал полученное вещество спиртом и предложил назвать его фенолом. Очень часто фенол называют карболовой кислотой. Фенол обладает ярко выраженными бактерицидными свойствами, поэтому и его довольно часто раньше применяли для дезинфекции помещений и даже для стерилизации хирургических инструментов. С тех времен осталось выражение «карболкой пахнет».
Состав молекулы фенола
молекула состоит из двух фрагментов. Запишите формулу бензола и один атом водорода замените на гидроксогруппу, получилась формула C6H5OH.

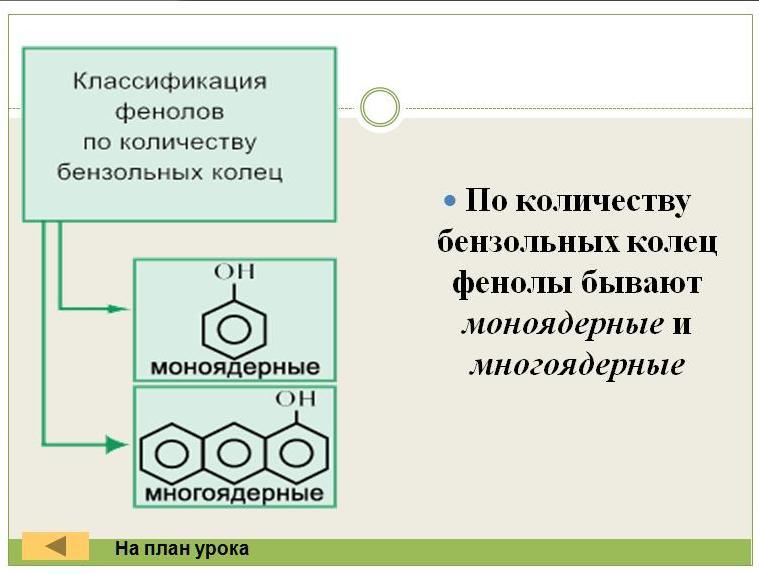
Рассмотри классификацию и номенклатуру фенолов

Примером многоатомного фенола является адреналин, вещество которое образуется при волнении, страхе.

Рассмотрим получение фенола

В промышленности из каменноугольной смолы.
Сообщение учащегося:
Каменный уголь представляет собой окаменелые останки доисторических растений. Наряду с природным газом и нефтью, он является важнейшим сырьевым источником химических веществ. Запасы каменного угля на планете значительно превышают запасы газа и нефти
(см. географическую карту) (рис. 1), поэтому химическое производство, основанное
на переработке угля (коксохимическое производство), имеет большое будущее.

Рис. 1. Расчетное время потребления природных источников углеводородов.

Рис. 2. Основные продукты коксохимического производства
Коксохимическое производство (рис. 2.) основано на нагревании каменного угля в специальных установках, называемых коксовыми батареями, без доступа воздуха. В результате коксования, которое проводят при температуре около 1000 °С, получают:
• коксовый газ, состоящий преимущественно из метана;
• каменноугольную смолу, содержащую несколько сотен различных органических соединений, в том числе бензол, фенол;
• аммиачную воду, содержащую, как видно из названия, растворенный аммиак, а также фенол и другие вещества;
• кокс — твердый остаток коксования, практически чистый углерод, используемый в производстве чугуна
Физические свойства фенола

Фенол представляет собой белые игольчатые кристаллы с характерным запахом, его можно почувствовать, если понюхать краски. Откройте баночку с гуашью, вы почувствуете специфический запах, так пахнет фенол. На воздухе фенол окисляется и становится розовым. Фенол плохо растворяется в холодной воде, но хорошо в горячей. У фенола достаточно высокие температуры плавления + 43 С, и кипения = 182 С, наличие гидроксогруппы и неподеленной пары электронов в атоме кислорода указывает на наличие водородных связей.
Фенол ядовит (демонстрирую денатурацию белка под действием фенола). При попадании на кожу рук вызывает ожоги, при этом он всасывается через кожу и вызывает отравление.При работе с фенолом необходимо соблюдать меры предосторожности, работать в перчатках и в вытяжном шкафу.
Вот как описывал А. П. Чехов в своем рассказе «Враги» действие фенола на организм человека: «По случаю дифтерита вся прислуга ещё с утра была выслана из дому. Кириллов, как был сюртука, в расстегнутой жилетке, не вытирая мокрого лица и рук, обожженных карболкой, пошел сам отворять дверь.»
Химические свойства фенола
Химические свойства фенола обусловлены сочетание двух фрагментов в составе его молекулы: ароматического углеводородного радикала фенила и гидроксогруппы. Вспомните положение теории химического строения органических соединений А. М. Бутлерого о взаимном влиянии атомов друг на друга в молекулах.
Рассмотрим смещение электронной плотности в молекуле фенола.

Радикал фенил притягивает на себя электронную плотность в результате чего полярность связи водород- кислород становится больше и атом водорода становится более подвижным по сравнению со спиртами, что обуславливает кислотные свойства фенола отсюда и название карболовая кислота.
Рассмотрим реакции идущие с участием гидроксогруппу.
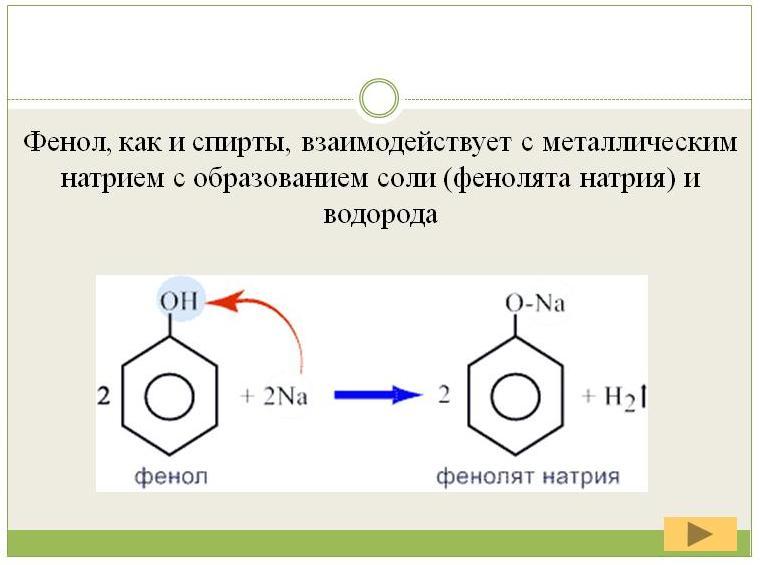
В отличии от спиртов фенол вступает в реакцию нейтрализации, взаимодействую со щелочами (демонстрация опыта).

Подобно алкоголятам фенолят натрия может быть получен при взаимодействии фенола с металлическим натрием (демонстрация опыта).
Реакции идущие с участием ароматического радикала- фенил
Взаимодействие с бромной водой (демонстрация опыта).
Влияние гидроксила на фенил состоит в том, что он делает атомы водорода в положении 2, 4, 6 более подвижными и поэтому фенол, в отличии от бензола, взаимодействует с бромной водой, образую осадок 2,4,6- трибромфенол.
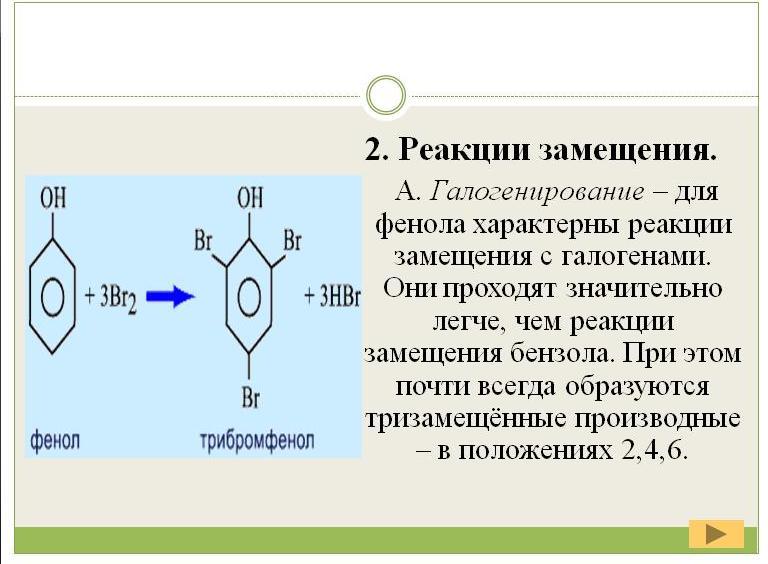
Эта реакция служит для качественного обнаружения фенола.
Реакция нитрования, взаимодействие с концентрированной азотной кислотой.

Реакция поликонденсации .

Так же качественная реакция на распознавания фенола является реакция с раствором хлорида железа (III); при этом образуется темно-фиолетовое окрашивание (Демонстрация опыта).
С помощью этой качественной реакции я предлагаю вам выполнить экспериментальное задание : обнаружить присутствие фенола
1. чайная заварка,
2. яблоко,
3. сигаретные фильтры.
Отчет о проделанной работе.


Отрицательное (токсическое) действие фенола:
фенолформальдегидные смолы, пестициды, гербициды, инсектициды, наличие фенола в табачном дыме, загрязнение вод фенольными отходами.
Положительное действие:
лекарственными препараты (пурген, парацетамол), антисептики (трех, пяти процентный раствор карболовая кислота), эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце- эвгенол в гвоздик, базилике)
Флаваноиды в чае способствуют удалению радиоактивных элементов из организма.
Тест
1. Вещество, формула которого СН3СН2ОН, относится к
а) одноатомным спиртам б) фенолам в) альдегидам г) многоатомным спиртам.
2. Гомологами являются
а) метанол и глицерин б) метанол и бутанол-1
в) уксусный альдегид и ацетон г) фенол и этанол.
3. Изомерами являются
а) метанол и этанол б) фенол и гексанол-1
в) ацетон и уксусный альдегид г) бутанол и 2-метилпропанол-2.
4. Водородная связь отсутствует между молекулами
а) одноатомных спиртов б) альдегидов в) гликолей г) трехатомных спиртов.
5. Реакцией Кучерова можно получить:
а) этаналь б) этанол в) глицерин г) фенол.
6. Реакцию «серебряного зеркала» дает:
а) этанол б) этандиол-1,2 в) пропантриол-1,2,3 г) глюкоза.
7. Образование белого осадка с бромной водой является качественной реакцией на
а) фенол б) глицерин в) метанол г) этиленгликоль.
8. Образование ярко- синего комплексного соединения с гидроксидом меди (II) является качественной реакций на
а) альдегиды б) многоатомные спирты в) фенолы г) кетоны.
9. Часть А
Что общего в строении молекул одноатомных и многоатомных спиртов?
10. Часть В Для этилового спирта характерны:
А) хорошая растворимость в воде
Б) наличие - связи в молекуле
В) пагубное действие на организм человека
Г) горение на воздухе
Д) реакция гидрирования
Е) реакция полимеризации.
(Проверка ответов Теста – КЛЮЧ на доске.)
КЛЮЧ 1- а; 2 – б; 3 – г; 4 – б; 5 – а; 6 – г; 7 – а; 8 – б.
Часть А - -ОН функциональная группа
Часть В – А, В,Г.
Подведение итогов ,оценки,рефлексия.
- Хорошо работали на уроке.
- Поставьте себе оценки за самостоятельную работу, и ту оценку за работу на уроке, которую, как вы считаете, заслужили.








































