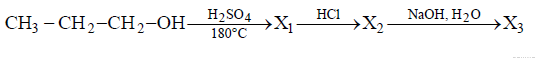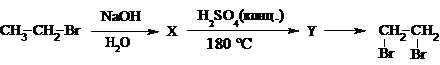Пояснительная записка КИМа по химии для 11 класса
1. Назначение КИМа для итоговой аттестационной работы
Контрольно-измерительный материал предназначен для проведения контрольной работы в форме ЕГЭ в 11 классе с фиксацией результатов по пятибалльной системе; для итоговой оценки уровня общеобразовательной подготовки выпускников средней школы, изучавших химию на базовом уровне.
2. Документы, определяющие содержание ВПР
Содержание контрольно-измерительного материала по химии определяется на основе Федерального компонента государственного образовательного стандарта среднего (полного) общего образования по химии, базовый уровень (приказ Минобразования России от 05.03.2004 № 1089 «Об утверждении Федерального компонента государственных стандартов начального общего, основного общего и среднего (полного) общего образования»).
3. Подходы к отбору содержания и разработке структуры КИМа
На основании ФК ГОС по химии базового уровня разработан кодификатор, определяющий перечень элементов содержания и перечень способов деятельности, выносимых на итоговую проверку (см. Приложение).
Разработка КИМа по химии осуществляется с учетом следующих общих положений:
КИМ ориентирован на проверку усвоения системы знаний и умений, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для средней школы. В Федеральном компоненте Государственного стандарта среднего общего образования эта система знаний и умений представлена в виде требований к уровню подготовки выпускников по химии (базовый уровень);
проверка сформированности усвоения основных элементов содержания курса химии осуществляется на двух уровнях сложности: базовом и повышенном;
учебный материал, проверяемый заданиями КИМа, отбирается с учетом его общекультурной значимости для общеобразовательной подготовки выпускников средней школы.
4. Структура и содержание КИМа
Каждый вариант КИМа содержит 15 заданий различных типов и уровней сложности.
| Форма задания | Номера заданий |
| На установление соответствия | 1,6,8,9,10 |
| С выбором 2 ответов | 2,5,7,11 |
| На восстановление последовательности | 3 |
| С кратким ответом | 12 |
| С развернутым ответом | 13,14,15 |
В вариантах представлены задания различного формата. Данные задания имеют различия по требуемой форме записи ответа.
В работе содержится 3 задания повышенного уровня сложности (их порядковые номера: 13, 14, 15). Эти задания более сложные, так как их выполнение предполагает комплексное применение следующих умений:
– составлять уравнения реакций, подтверждающих свойства веществ и/или взаимосвязь различных классов веществ, и электронный баланс окислительно-восстановительной реакции;
–- объяснять обусловленность свойств и способов получения веществ их составом и строением;
– моделировать химический эксперимент на основании его описания.
Включенные в работу задания условно могут быть распределены по четырем содержательным блокам: «Теоретические основы химии», «Неорганическая химия», «Органическая химия», «Методы познанияв химии. Экспериментальные основы химии. Химия и жизнь» (табл. 1).
Таблица 1. Распределение заданий по основным
содержательным блокам курса химии
| Содержательные блоки курса химии | Количество заданий |
| Теоретические основы химии | 6 |
| Неорганическая химия | 4 |
| Органическая химия | 3 |
| Методы познания в химии. Экспериментальные основы химии. Химия и жизнь | 2 |
| ИТОГО | 15 |
Наряду с усвоением элементов содержания задания, включенные в проверочную работу, проверяют овладение учащимися определенными умениями и способами действий, которые отвечают требованиям к уровню подготовки выпускников. Представление о распределении заданий по видам проверяемых умений и способам действий дает таблица 2.
Таблица 2. Распределение заданий по видам умений и способам действий
| Основные умения и способы действий | Номера заданий |
| Знать/понимать: важнейшие химические понятия, основные законы и теории химии, важнейшие вещества и материалы | 1 |
| Уметь: называть изученные вещества по тривиальной или международной номенклатуре | 10 |
| определять/классифицировать: валентность, степень окисления химических элементов, заряды ионов; вид химических связей в соединениях и тип кристаллической решётки; характер среды водных растворов веществ; окислитель и восстановитель; принадлежность веществ к различным классам неорганических и органических соединений; гомологи и изомеры; химические реакции в неорганической и органической химии (по всем известным классификационным признакам) | 6,10,13 |
| характеризовать: s-, p- и d-элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства основных классов неорганических соединений, свойства отдельных представителей этих классов; строение и химические свойства изученных органических соединений | 2,3,7,8,9,11 |
| объяснять: зависимость свойств химических элементов и их соединений от положения элемента в Периодической системе Д.И. Менделеева; природу химической связи (ионной, ковалентной, металлической, водородной); зависимость свойств неорганических и органических веществ от их состава и строения; сущность изученных видов химических реакций (электролитической диссоциации, ионного обмена, окислительно-восстановительных); составлять уравнения изученных видов химических реакций | 3,5,13,14,15 |
| планировать/проводить: эксперимент по получению и распознаванию важнейших неорганических и органических соединений, с учетом приобретенных знаний о правилах безопасной работы с веществами в лаборатории и в быту; вычисления по химическим формулам и уравнениям | 12,14,15 |
В работе содержатся задания базового и повышенного уровней сложности. В таблице 3 представлено распределение заданий по уровню сложности.
Таблица 3. Распределение заданий по уровню сложности
| Уровень сложности заданий
| Количество заданий
| Максимальный балл
| Процент максимального балла за задания данного уровня сложности от максимального первичного балла за всю работу, равного 33
|
| Базовый | 12 | 17 | 80 |
| Повышенный | 3 | 9 | 20 |
| ИТОГО | 15 | 26 | 100 |
5. Обобщенный план вариантов КИМа по ХИМИИ за курс 11 класса
| №
| | Проверяемые элементы содержания |
| Коды проверяемых элементов содержания по коди-фикатору ЕГЭ | Уровень сложности задания
| Макс. балл за выпол-нение задания
|
| Теоретические основы химии |
| 1 | Основные способы получения конкретных веществ | 4.1.6 | Б | 2 |
| 2 | Состав атома. Протоны, нейтроны, электроны. Строение электронных оболочек атомов | 1.1 | Б | 1 |
| 3 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева | 1.2 | Б | 2 |
| 4 | Виды химической связи. Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток | 1.3.1 1.3.3 | Б | 1 |
| 5 | Электролитическая диссоциация. Сильные и слабые электролиты. Реакции ионного обмена. Среда водных растворов: кислая, нейтральная, щелочная | 1.4.5 1.4.6 1.4.7 | Б | 1 |
| 13 | Реакции окислительно-восстановительные | 1.4.8 | П | 3 |
| Неорганическая химия |
| 6 | Классификация и номенклатура неорганических соединений | 2.11 | Б | 2 |
| 7 | Характерные химические свойства простых веществ – металлов и неметаллов. Характерные химические свойства оксидов (оснόвных, амфотерных, кислотных) | 2.21 2.4 | Б | 1 |
| 8 | Характерные химические свойства оснований, амфотерных гидроксидов, кислот, солей (средних) | 2.5 2.6 2.7 | Б | 1 |
| 9 | Взаимосвязь неорганических веществ | 2.8 | Б | 1 |
| Органическая химия |
| 10 | Классификация и номенклатура органических соединений. Теория строения органических соединений. Углеродный скелет. Радикалы. Функциональные группы. Гомологический ряд, гомологи. Структурная изомерия. Типы химических связей в молекулах органических соединений | 3.1 3.2 3.3 | Б | 2 |
| 11 | Характерные химические свойства: алканов, алкенов, алкадиенов, алкинов, аренов; кислородсодержащих соединений: одно- и многоатомные спирты, фенол, альдегиды, однооснóвные карбоновые кислоты, сложные эфиры, жиры, углеводы; азотсодержащих соединений: аминов аминокислот, белков | 3.4 3.5 3.6 3.7 | Б | 1 |
| 14 | Взаимосвязь между основными классами органических веществ | 3.9 | П | 3 |
| Методы познания в химии. Химия и жизнь |
| 15 | Проведение расчетов количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Природные источники углеводородов: нефть и природный газ | 4.2.3 4.3.3 | П | 3 |
| 12 | Проведение расчетов с использованием понятия «массовая доля вещества в растворе» | 4.3.1 | Б | 2 |
Инструкция для учителя
Условия:
Количество вариантов заданий
Для проведения итоговой аттестационной работы предусмотрено 2 варианта.
Время выполнения работы
На выполнение всей работы отводится 45 минут.
Дополнительные материалы и оборудование
В процессе выполнения работы учащийся может использовать следующие дополнительные материалы:
Периодическая система химических элементов Д.И. Менделеева;
таблица растворимости солей, кислот и оснований в воде;
электрохимический ряд напряжений металлов;
непрограммируемый калькулятор.
Последовательность выполнения заданий
При выполнении работы сначала выполняются задания базового уровня сложности (1-12), затем повышенного.
Правила оформления работы
Ответы на задания итоговой аттестационной работы записываются в тексте работы в отведенных для этого местах. В инструкции к варианту описываются правила записи ответов к заданиям.
Перечень литературы, учебников рекомендованный учащимся для подготовки к аттестации по данному учебному предмету, курсу
К выполнению работы можно готовиться по учебникам: - Химия 10 класс Г.Е. Рудзитис, Ф.Г. Фельдман (2012 год) - Химия 11 класс Г.Е. Рудзитис, Ф.Г. Фельдман (2012 год).
Критерии оценки
Система оценивания отдельных заданий и работы в целом
Верное выполнение заданий с порядковыми номерами 2,4,5,7,8,9,11 оценивается в 1 балл.
Верное выполнение каждого из остальных заданий базового уровня сложности оценивается максимально 2 баллами. В случае наличия одной ошибки или неполного ответа выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Оценивание заданий повышенного уровня сложности осуществляется на основе поэлементного анализа ответов учащихся. Максимальная оценка за верно выполненное задание составляет 3 балла. Задания с развернутым ответом могут быть выполнены учащимися разными способами. Поэтому приведенные в критериях оценивания образцы решений следует рассматривать лишь как один из возможных вариантов ответа.
| Количество первичных баллов | Процент выполнения | Отметка |
| Менее 13 | Менее 50 | 2 |
| 13-18 | 50-70 | 3 |
| 19-23 | 71-90 | 4 |
| 24-26 | 91-100 | 5 |
Эталоны ответов
| № вопроса | 1 вариант | 2 вариант |
| 1 | 2415 | 5143 |
| 2 | 3,5 | 2,5 |
| 3 | 2,3,4 | 1,3,2 |
| 4 | 1,5 | 2,3 |
| 5 | 1,4 | 4,5 |
| 6 | 3,4,2 | 3,4,2 |
| 7 | 3,5 | 1,4 |
| 8 | 4,2 | 3,1 |
| 9 | 5,4 | 3,5 |
| 10 | 4,2,1 | 2,3,4 |
| 11 | 2,4 | 1,4 |
| 12 | 400 г | 650 г |
Итоговая аттестация по курсу 11 класса (УМК Рудзитиса, Фельдмана)
Вариант 1
1. Установите соответствие между веществом и источником его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | | ИСТОЧНИК ПОЛУЧЕНИЯ |
| A) диоксид серы Б) водород В) азот Г) хлор | | 1) воздух 2) пирит 3) древесина 4) вода 5) водный раствор хлорида натрия |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Определите, атомы, каких из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов. 1) Na 2) K 3) Si 4) Mg 5) C
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
Cl 2) Rb 3) Sn 4)Te 5) F
Ответ:
Соединения с ковалентной неполярной связью расположены в рядах:
1) O2, Cl2, H2 2) HCl, N2, F2 3) O2, P4, H2O
4) NH3, S8, NaF 5) Cl2, N2, Br2
Ответ:
Сокращенному ионному уравнению Н+ +СО32- → Н2О +СО2 соответствуют две пары реагентов:
HCl и Na2CO3 2) H2SO4 и CaCO3 3) H2O и Na2SiO3
H2SO4 и K2CO3 5) H2CO3 и NaOH
Ответ:
6. Установите соответствие между классом (группой) неорганических соединений и химическими формулами веществ, к которому они принадлежат.
| КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | ХИМИЧЕСКАЯ ФОРМУЛА |
| А) средняя соль Б) кислая соль В) основание | 1) Al(OH)Cl2 2) Mg(OH)2 3) NH4Cl 4) NaHCO3 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
7. Оксид бария реагирует с каждыми из двух веществ:
1) оксидом цинка и хлороводородом
2) оксидом углерода (II) и кислородом
3) оксидом фосфора (V) и водородом
4) оксидом кремния и азотом
5) оксидом азота (V) и водой
В ответе укажите две верные пары веществ.
Ответ:
8. В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) KOH 2) HCl 3) Cu(NO3)2 4) K2SO3 5) Na2SiO3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
9. В схеме превращений FeO
+H2→ X
1 +HCl→ X
2 . Веществами «X
1» и «X
2» являются
1) Fe(ClO)2 2) FeCl3 3) Fe3O4 4) FeCl2 5) Fe
Ответ:
10. Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | | КЛАСС/ГРУППА |
| А) метилбензол Б) анилин В) 3-метилбутаналь | | 1) альдегиды 2) амины 3) аминокислоты 4) углеводороды |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
11. Уксусная кислота может реагировать с каждыми из двух веществ:
1) метанолом и серебром
2) гидроксидом меди (II) и метанолом
3) серебром и гидроксидом меди (II)
4) этанолом и гидроксидом кальция
5) магнием и метаном
В ответе укажите две верные пары веществ.
Ответ:
12. Вычислите массу воды, которую надо выпарить из 1 кг 3%-ного раствора сульфата меди для получения 5% -ного раствора. Ответ запишите в граммах.
Ответ:
13. Используя метод электронного баланса, составьте уравнение реакции:
NO2 + KOH → KNO2 + KNO3 + Н2О,
Определите окислитель и восстановитель.
Ответ:
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
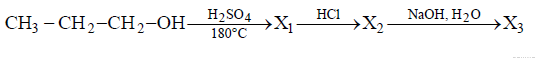
При написании уравнений реакции используйте структурные формулы органических веществ.
Ответ:
15. Рассчитайте массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора. Ответ укажите в граммах с точностью до целых.
Дано: Решение:
Найти:
Итоговая аттестация по курсу 11 класса (УМК Рудзитиса, Фельдмана)
Вариант 2
1. Установите соответствие между веществом и источником его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | | ИСТОЧНИК ПОЛУЧЕНИЯ |
| А) полиэтилен Б) кислород В) углекислый газ Г) железо | | 1) воздух 2) вода 3) гематит 4) дымовые газы 5) этилен |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Определите, атомы, каких из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов. Запишите в поле ответа номера выбранных элементов. 1) Na 2) Аs 3) Si 4) Mg 5) Sb
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) K 2) Se 3) Ge 4) O 5) P
Ответ:
Соединения с ковалентной полярной связью расположены в рядах:
1) O2, Cl2, H2 2) HCl, N2O, HF 3) SO2, P2O5, H2O
4) NH3, S8, NaF 5) Cl2, N2, Br2
Ответ:
5. Сокращенному ионному уравнению Сu2+ + OH- → Cu(OH)2 соответствуют две пары реагентов:
1) CuS и KOH 2) Cu(NO3)2 и Ca(OH)2 3) H2O и Cu(NO3)2
CuSO4 и NaOH 5) Cu(NO3)2 и NaOH
Ответ:
6. Установите соответствие между классом (группой) неорганических соединений и химическими формулами веществ, к которому они принадлежат.
| КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | ХИМИЧЕСКАЯ ФОРМУЛА |
| А) средняя соль Б) кислая соль В) основание | 1) Ca(OH)Cl 2) Mn(OH)2 3) NH4Cl 4) (NH4)2HPO4 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
7. Из предложенного перечня выберите два вещества, которые реагируют как с оксидом серы(VI), так и с оксидом серы(IV)
1) гидроксид калия
2) соляная кислота
3) оксид кремния (IV)
4) оксид натрия
5) кислород
В ответе укажите две верные пары веществ.
Ответ:
8. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выпадение осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) NaOH 2) HCl 3) Cu(NO3)2 4) BaSO4 5) K2SO4
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
9. В схеме превращений Al
2S
3 +X→ H
2S
+Y→ SO
2 . Веществами «X» и «Y» являются
1) Ca 2) NaOH 3) H2O 4) NH3 5) O2
Ответ:
10. Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | | КЛАСС/ГРУППА |
| A) метаналь Б) глицерин B) глицин
| | 1) арены 2) альдегиды 3) спирты 4) аминокислоты |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:11. Муравьиная кислота взаимодействует с
1) пропанолом
2) хлоридом натрия
3) гидросульфатом натрия
4) метанолом
5) метаном
В ответе укажите два верных вещества.
Ответ:
12. Какую массу воды надо добавить к 50 г 70%-ного раствора серной кислоты для получения раствора с массовой долей кислоты 5%? (Ответ запишите в граммах).
Ответ:
13. Используя метод электронного баланса, составьте уравнение реакции:
KNO3 + NH4Cl → KCl + N2O + H2O,
Определите окислитель и восстановитель.
Ответ:
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
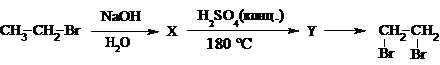
При написании уравнений реакции используйте структурные формулы органических веществ.
Ответ:
15. Чему равен объём газа (н.у.), образовавшегося в результате растворения 40 г карбоната кальция в избытке соляной кислоты? Ответ укажите в литрах с точностью до десятых.
Дано: Решение:
Найти: