Пояснительная записка
1. Назначение КИМа для промежуточной аттестационной работы
Контрольно-измерительный материал предназначен для проведения промежуточной аттестации по химии в 8 классе в форме годовой контрольной работы с фиксацией результатов по пятибалльной системе.
Цель работы: Выявить сформированность базовых умений по химии на второй ступени общего образования.
2. Документы, определяющие содержание ВПР
Содержание контрольно-измерительного материала по химии определяется на основе Федерального компонента государственного образовательного стандарта среднего (полного) общего образования по химии, базовый уровень (приказ Минобразования России от 05.03.2004 № 1089 «Об утверждении Федерального компонента государственных стандартов начального общего, основного общего и среднего (полного) общего образования»).
3. Подходы к отбору содержания и разработке структуры КИМа
На основании ФК ГОС по химии базового уровня разработан кодификатор, определяющий перечень элементов содержания и перечень способов деятельности, выносимых на итоговую проверку.
Разработка КИМа по химии осуществляется с учетом следующих общих положений:
КИМ ориентирован на проверку усвоения системы знаний и умений, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для средней школы. В Федеральном компоненте Государственного стандарта среднего общего образования эта система знаний и умений представлена в виде требований к уровню подготовки выпускников по химии (базовый уровень);
проверка сформированности усвоения основных элементов содержания курса химии осуществляется на двух уровнях сложности: базовом и повышенном;
учебный материал, проверяемый заданиями КИМа, отбирается с учетом его общекультурной значимости для общеобразовательной подготовки выпускников средней школы.
План КИМа
| №. | Название раздела | Номера вопросов |
| 1. | Первоначальные химические понятия | А2,А3,А4,А8,А9,А12,В3 |
| 2. | Кислород. Оксиды, горение | А8 |
| 3. | Растворы. Вода. | В2 |
| 4. | Основные классы неорганических соединений. | А5,А6,В1 |
| 5. | Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома. | А1,А10 |
| 6. | Химическая связь. Строение вещества. | А7,А11 |
4. Структура и содержание КИМа
Каждый вариант КИМа содержит 15 заданий различных типов и уровней сложности.
| Форма задания | Номера заданий |
| С выбором 1 ответа | 1,2,3 |
| На установление соответствия | 4,5,6 |
| С выбором 2 ответов | 7,8 |
| Задания с альтернативным ответом | 9 |
| На восстановление последовательности | 10,11 |
| С кратким ответом | 12 |
| С развернутым ответом | 13,14,15 |
Данная работа соответствуют обязательному минимуму содержания по химии и требованиям к уровню подготовки выпускников 8-го класса основной общеобразовательной школы. Каждый вариант содержит пятнадцать заданий из них двенадцать базового уровня сложности: три задания с выбором 1 ответа по разным темам курса, три задания с выбором 2 ответов, два на установление соответствия, один с альтернативными ответами, два на восстановление последовательности, один с кратким ответом и три задания с полным решением - повышенного уровня.
Задания проверочной работы ориентированы на проверку овладения учащимися определёнными видами умений.
| Вопрос | Проверяемый элемент | Коды проверяемых элементов содержания (см. кодификатор ОГЭ) |
| А1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева. | 1.1 |
| А2 | Простые и сложные вещества. Основные классы неорганических веществ. | 1.6 |
| А3 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. | 2.1 |
| А4 | Чистые вещества и смеси. Разделение смесей и очистка веществ. | 1.5 |
| А5 | Валентность химических элементов. | 1.4 |
| А6 | Номенклатура неорганических соединений | 4.1 |
| А7 | Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная | 1.3 |
| А8 | Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии | 2.2 |
| А9 | Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. | 4.1 |
| А10 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева | 1.2 |
| А11 | Степень окисления химических элементов | 1.4 |
| А12 | Вычисление массовой доли химического элемента в веществе | 4.5.1 |
| В1 | Химические свойства простых веществ. Химические свойства сложных веществ. Взаимосвязь различных классов неорганических веществ. | 3.1 3.2 3.3 |
| В2 | Вычисление массовой доли растворенного вещества в растворе | 4.5.2 |
| В3 | Расчетная задача по уравнению реакции | 4.5.3 |
| Спецификация работы |
| № задания | Проверяемые умения | Уровень |
| Знать |
|
| А4 | Чистые вещества и смеси. | Б |
| А9 | Правила безопасной работы в школьной лаборатории. | Б |
| Называть |
|
| А6 | Называть химические соединения по формулам | Б |
| А3 | Называть признаки и условия осуществления химических реакций | Б |
| Составлять |
|
| А12 | Составлять формулы веществ по названию | Б |
| В1 | Составлять уравнения химических реакций | Б |
| Характеризовать |
|
| В1 | Характеризовать характерные химические свойства основных классов соединений | Б |
| Объяснять |
|
| А1 | Объяснять физический смысл порядкового номера химического элемента, номеров группы (для элементов главных подгрупп) и периода в Периодической системе, к которым принадлежит элемент; | Б |
| А10 | Объяснять закономерности в изменении свойств химических элементов и их соединений в зависимости от положения в Периодической системе; | Б |
| В1 | Объяснять взаимосвязь веществ | П |
| Определять |
|
| А2 | Определять принадлежность веществ к простым и сложным веществам | Б |
| А5 | Определять принадлежность веществ к определенному классу неорганических соединений | Б |
| А8 | Определять тип химической реакции | Б |
| А7 | Определять вид химической связи | Б |
| А11 | Определять степень окисления элементов |
|
| Вычислять |
|
| А12 | Вычислять массовую долю элемента в веществе | Б |
| В2 | Вычислять массовую долю вещества в растворе | Б |
| В3 | Вычислять количество вещества, объем или массу по количеству вещества, объему, или массе реагентов, или продуктов реакции. | П |
Инструкция для учителя
Условия:
Количество вариантов заданий
Для проведения промежуточной аттестационной работы предусмотрено 2 варианта.
Время выполнения работы
На выполнение всей работы отводится 45 минут.
Дополнительные материалы и оборудование
В процессе выполнения работы учащийся может использовать следующие дополнительные материалы:
Периодическая система химических элементов Д.И. Менделеева;
таблица растворимости солей, кислот и оснований в воде;
электрохимический ряд напряжений металлов;
непрограммируемый калькулятор.
Последовательность выполнения заданий
При выполнении работы сначала выполняются задания базового уровня сложности (1-12), затем повышенного.
Правила оформления работы
Ответы на задания итоговой аттестационной работы записываются в тексте работы в отведенных для этого местах. В инструкции к варианту описываются правила записи ответов к заданиям.
Перечень литературы, учебников рекомендованный учащимся для подготовки к аттестации по данному учебному предмету, курсу
К выполнению работы можно готовиться по учебникам: - Химия 8 класс Г.Е. Рудзитис, Ф.Г. Фельдман (2012 год)
Критерии оценки
Система оценивания отдельных заданий и работы в целом
Задания 1,2,3 оцениваются по 1 баллу. Задания 4 - 12 – в 2 балла. Задания 13,14,15 – в 3 балла. Всего – 30 баллов.
Оценивание заданий повышенного уровня сложности осуществляется на основе поэлементного анализа ответов учащихся. Максимальная оценка за верно выполненное задание составляет 3 балла. Задания с развернутым ответом могут быть выполнены учащимися разными способами. Поэтому приведенные в критериях оценивания образцы решений следует рассматривать лишь как один из возможных вариантов ответа.
Результаты обучения оцениваются по пятибалльной системе.
Оценивание:
15 – 20 - первичных баллов – оценка «3»
21-26 – оценка «4»
27-30 – оценка «5»
.
Эталоны ответов
| № вопроса | 1 вариант | 2 вариант |
| 1 | 1 | 2 |
| 2 | 3 | 2 |
| 3 | 1 | 2 |
| 4 | БАВ | БАВ |
| 5 | БАГВ | БГАВ |
| 6 | АВБГ | ДВБЕ |
| 7 | 1,6 | 2,5 |
| 8 | 1,2 | 2,3 |
| 9 | Нет, да, нет, нет, да | Нет, да, нет, да, да |
| 10 | 2,3,4,1 | 1,4,3,2 |
| 11 | 3,4,1,2 | 3,1,2,4 |
| 12 | 72,7% | 50% |
| 13 | FeCl2+2NaOH= Fe(OH)2 +2NaCl Fe(OH)2=t FeO +H2O FeO + 2HCl = FeCl2+H2O | 2Al+3H2SO4= Al2(SO4)3 +3H2 Al2(SO4)3+3NaOH= Al(OH)3+Na2SO4 2Al(OH)3=t Al2O3 + 3H2O |
| 14 | 9,09% | 11,8% |
| 15 | 8,8 г | 8,0 г |
Промежуточная аттестация по курсу 8 класса (УМК Рудзитиса, Фельдмана)
Вариант 1
В заданиях А1-А3 выберите номер правильного ответа.
А1. На приведённом рисунке
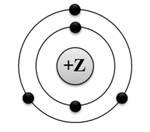
изображена модель атома
бора 2) алюминия 3) азота 4) берилия
Ответ
А2. В ряду расположены формулы только простых веществ
вода, кислород, кальций
оксид натрия, хлороводород, азотная кислота
сера, фосфор, медь
калий, хлор, гидроксид магния
Ответ
А3. При растворении магния в соляной кислоте можно наблюдать:
1) выделение газа 2) изменение цвета
3) появление запаха 4) выпадение осадка
Ответ
В заданиях А4-А6 установите соответствие, и запишите буквы выбранных вами ответов
А4. Установите соответствие между столбцами
| СМЕСЬ | СПОСОБ РАЗДЕЛЕНИЯ СМЕСЕЙ |
Смесь железных и древесных опилок | А) фильтрование |
Смесь речного песка в воде | Б) действие магнитом |
Раствор поваренной соли в воде | В) выпаривание |
Ответ:
А5. Установите соответствие между формулой соединения и классом, к которому относится это соединение
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
SO2 | А) кислота |
H2CO3 | Б) оксид |
CaSiO3 | В) основание |
Mg(OH)2 | Г) соль |
Ответ:
А6. Установите соответствие между формулой соединения и его названием
| ФОРМУЛА ВЕЩЕСТВА | НАЗВАНИЕ ВЕЩЕСТВА |
NО | А) оксид азота (II) |
KNO2 | Б) азотная кислота |
HNO3 | В) нитрит калия |
Fe(NO3)2 | Г) нитрат железа (II) |
|
| Д) оксид азота (I) |
|
| Е) нитрат железа (III) |
Ответ:
В заданиях А7-А8 выберите все верные ответы из предложенных.
А7. Выпишите формулы веществ в молекулах, которых ковалентная полярная химическая связь 1) SO2 2) O3 3) NaF 4)K 5) H2 6)H2S
Ответ:
А8. Выберите классификационные характеристики реакции, уравнение которой 2SО2 + О2  2SО3 + Q
2SО3 + Q
Экзотермическая
Эндотермическая
Соединения
Замещения
Разложения
Ответ:
А9 . Если согласны с утверждением, то в таблице ответов напротив утверждения обведите «да», если не согласны – обведите «нет».
| № | Утверждения |
|
|
| 1. | Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро. | да | нет |
| 2. | Красками, содержащими соединения свинца, не рекомендуется покрывать детские игрушки и посуду. | да | нет |
| 3. | Для определения состава вещества, содержащегося в склянке без этикетки, его можно попробовать на вкус. | да | нет |
| 4. | При нагревании жидкости необходимо закрыть пробирку пробкой. | да | нет |
| 5. | При работе с растворами едких веществ необходимо надевать защитные перчатки и очки | да | нет |
В заданиях А10-А11 выпишите цифры в заданном в задании порядке.
А 10. Расположите символы элементов в порядке возрастания металлических свойств
натрий 2) хлор 3) фосфор 4) алюминий
Ответ:
А11. Расположите формулы веществ по увеличению степени окисления серы в них
Ответ:
А12. Рассчитайте массовую долю кислорода в оксиде углерода (IV).Ответ запишите с точностью до десятых.
Ответ:
В заданиях (В1,В2,В3) запишите полное решение. Ответы записывайте четко и разборчиво.
В1. Дана схема превращений: FeCl2 → Fe(OH)2 → FeO → FeСl2
Напишите уравнения реакций, с помощью которых можно осуществить указанные превращения.
Ответ:
В2. В 70 г воды растворили 7 г соли, вычислите массовую долю соли в полученном растворе.
Дано: Решение:
Найти:
В3. Вычислите массу оксида углерода (IV), полученного при сжигании 2,4г углерода.
Дано: Решение:
Найти:
Промежуточная аттестация по курсу 8 класса (УМК Рудзитиса, Фельдмана)
Вариант 2
В заданиях А1-А3 выберите номер правильного ответа.
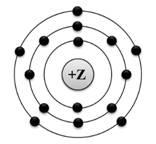
| А1. На приведённом рисунке изображена модель атома 1) бора 2) фосфора 3) мышьяка 4) брома
| 
|
Ответ:
А2. В ряду расположены формулы только сложных веществ
вода, кислород, кальций
оксид натрия, хлороводород, азотная кислота
сера, фосфор, медь
калий, хлор, гидроксид магния
Ответ:
А3. При пропускании водорода над оксидом меди (II) можно наблюдать:
1) выделение газа 2) изменение цвета
3) появление запаха 4) выпадение осадка
Ответ
В заданиях А4-А6 установите соответствие, и запишите буквы выбранных вами ответов
А4. Установите соответствие между смесью и способом разделения данной смеси
| Смесь | Способ разделения |
Смесь железных и алюминиевых стружек | А) фильтрование |
Смесь древесных опилок в воде | Б) действие магнитом |
Раствор сахара в воде | В) выпаривание |
Ответ:
А5. Установите соответствие между формулой соединения и классом, к которому относится каждое соединение
| Формула | Класс |
CO2 | А) кислота |
K2CO3 | Б) оксид |
H2SiO3 | В) основание |
Cu(OH)2 | Г) соль |
Ответ:
А6. Установите соответствие между формулой соединения и названием
| Формула | Название |
N2О | А) оксид азота (II) |
KNO3 | Б) азотистая кислота |
HNO2 | В) нитрат калия |
Fe(NO3)3 | Г) нитрат железа (II) |
|
| Д) оксид азота (I) |
|
| Е) нитрат железа (III) |
Ответ:
В заданиях А7-А8 выберите все верные ответы из предложенных.
А7. Выпишите формулы веществ в молекулах, которых ковалентная неполярная химическая связь 1) SO2 2) O3 3) NaF 4)K 5) H2 7) НCl
Ответ:
А8. Охарактеризуйте реакцию, уравнение которой 
Экзотермическая
Эндотермическая
Разложения
Замещения
Соединения
Ответ:
А9 . Если согласны с утверждением, то в таблице ответов напротив утверждения обведите «да», если не согласны – обведите «нет».
| № | Утверждения |
|
|
| 1. | Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро. | да | нет |
| 2. | Красками, содержащими соединения свинца, не рекомендуется покрывать детские игрушки и посуду. | да | нет |
| 3. | Для определения состава вещества, содержащегося в склянке без этикетки, его можно попробовать на вкус. | да | нет |
| 4. | При работе с растворами едких веществ необходимо надевать защитные перчатки и очки. | да | нет |
| 5. | Работать с горючими жидкостями необходимо вдали от источников огня. | да | нет |
Ответ:
В заданиях А10-А12 выпишите цифры в заданном в задании порядке.
А 10. Расположите символы элементов в порядке убывания металлических свойств
1)натрий 2) хлор 3)фосфор 4)алюминий
Ответ:
А11. Расположите формулы веществ по увеличению степени окисления марганца в них
Ответ:
А12. Рассчитайте массовую долю кислорода в оксиде серы (IV).Ответ запишите с точностью до десятых.
Ответ:
В заданиях (В1,В2,В3) запишите полное решение. Ответы записывайте четко и разборчиво.
В1. Дана схема превращений: 
Напишите уравнения реакций, с помощью которых можно осуществить указанные превращения.
Ответ:
В2. В 150 г воды растворили 20 г соли, вычислите массовую долю соли в полученном растворе.
Дано: Решение:
Найти:
В3. Вычислите массу оксида серы (IV), полученного при сжигании 3,2 г серы.
Дано: Решение:
Найти:


















