Лабораторная работа № 12.
Исследование свойств белков.
Цель: Исследование свойства белков.
Норма времени: 2 часа.
Реактивы и оборудование: 1. Раствор яичного белка (1%). 2. Гидроксид натрия (10%). 3. Сернокислая медь (1%). 4. Азотная кислота концентрированная. 5. Насыщенный раствор хлористого натрия. 6.Спирт этиловый (95%), компьютер, проектор, обучающее видео.
Литература: : Учебник «Физическая и коллоидная химия» (в общественном питании): учебное пособие/ С.В.Горбунцова, Э.А.Муллоянова. –М. : Альфа-М: ИНФРА-М, 2016
Качественные цветные реакции на функциональные группы белков и аминокислот
При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено присутствием в молекуле белка той или иной аминокислоты, имеющей в своем составе определенную химическую группировку.
Значение качественных цветных реакций на функциональные группы белков и аминокислот в том, что они дают возможность обнаружить присутствие белка в биологических жидкостях, растворах, лекарственных препаратах и идентифицировать индивидуальные аминокислоты. Эти реакции применяют как для качественного, так и для количественного определения белка и содержащихся в нем аминокислот.
Порядок проведения работы. (Просмотрите видео – опыты)
1.Биуретовая реакция на пептидную связь (Пиотровского).
Биуретовая реакция открывает пепетидную связь 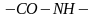 в белке.
в белке.
Её способны давать вещества, которые содержат не менее двух пептидных связей. Положительную биуретовую реакцию отдельные аминокислоты не дают, за исключением гистидина (His), серина (Ser), треонина (The) и аспарагина (Asn), с которыми биуретовая реакция получается при условии больших концентраций их в растворе. При добавлении сернокислой меди к сильнощелочному раствору белка или полипептида образуются соединения меди с пепетидной группировкой, окрашенные в красно-фиолетовый или сине-фиолетовый цвет в зависимости от длины полипептидной цепи. Раствор белка даёт сине-фиолетовое окрашивание, а продукты неполного гидролиза (пептоны) – розовое или красное окрашивание.
Принцип метода. В сильно щелочной среде пептидные группы полипептидных цепей переходят в фенольную форму, которая, взаимодействуя с ионами Cu2+ , образует окрашенный (фиолетового цвета) биуретовый комплекс.
При этом фенольная форма полипептида, образованная в сильнощелочной среде, дает отрицательный заряд, и ее кислород, взаимодействуя с медью, образует ковалентную связь, а медь, взаимодействуя с атомами азота, образует координационные связи.
Ход работы
К 5 каплям раствора белка прибавляют 3 капли 10% раствора едкого натра и 1 каплю 1% раствора сернокислой меди и перемешивают. Содержимое пробирки приобретает сине-фиолетовый цвет.
Нельзя добавлять избыток сернокислой меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
2.Ксантопротеиновая реакция.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот – фенилаланина (Phe), тирозина (Tyr), триптофана (Trp), а также свободные перечисленные кислоты. Белки, в которых циклические аминокислоты отсутствуют, не дают ксантопротенновой реакции.
Ход работы
В пробирку вносят 0,5 мл раствора яичного белка. Добавляют 0,5 мл концентрированной азотной кислоты и осторожно нагревают. Вначале появляется осадок свернувшегося белка (под влиянием кислоты), который при нагревании окрашивается в желтый цвет.
После охлаждения в пробирку наливают по каплям 10% раствор едкого натра до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина.
3.Осаждение белков нагреванием.
Устойчивость белка в растворе к нагреванию зависит от наличия заряда (положительного в сильнокислой среде и отрицательного - в щелочной среде). Полное и быстрое осаждение белков происходит в изоэлектрической точке, которая для большинства белков соответствует слабокислой среде (рН около 5,5).
Принцип метода. При нагревании растворов белка вначале отмечается увеличение опалесценции и появление мути (коагуляции). При дальнейшем повышении температуры - появление хлопьевидного осадка белка (седиментация). При кипячении происходит необратимое изменение природных свойств белка (денатурация).
Ход работы
В 5 пробирок наливают по 0,5 мл раствора яичного белка (ИЭТ=4,8).
В первой пробирке нейтральный раствор белка нагревают до кипения. Отмечают появление мути, связанное с разрушением водной оболочки вокруг молекул белка и укрупнению его частиц; мицеллы белка несут заряд и удерживаются во взвешенном состоянии.
Во вторую пробирку прибавляют 3 капли 1% раствора уксусной кислоты, создавая слабокислую среду. Раствор белка нагревают до кипения и частицы белка при этом теряют заряд и приближаются к изоэлектрическому состоянию.
В третью пробирку добавляют 15 капель 1% раствора уксусной кислоты и нагревают раствор до кипения.
В четвертую пробирку наливают 15 капель 1% раствора уксусной кислоты для получения сильнокислой реакции, 2 капли насыщенного раствора хлористого натрия и нагревают. Выпадает хлопьевидный осадок белка, так как частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлористого натрия.
В пятую пробирку добавляют 6 капель 10% раствора едкого натра, создавая щелочную среду, и нагревают. В каждой пробирке определяют рН среды с помощью индикатора. При кипячении жидкости осадок не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается.
Отмечают, в какой пробирке произошло осаждение белка, а в какой - нет.
Делают выводы о влиянии рН среды на белковые макромолекулы и выпадение белка в осадок. Результаты оформляют в виде таблицы (1).
4.Осаждение белка органическими растворителями.
В органических растворителях, таких как спирт, ацетон и др., белки не растворяются и выпадают в осадок. Однако, кратковременное воздействии органических растворителей при низкой температуре от 0 до 100С сохраняет белок в нативном состоянии, что используется в фармацевтической практике для получения отдельных белковых препаратов, например гормона инсулина. При длительном воздействии органических растворителей наступает необратимая денатурация белка.
Принцип метода. Спирт, связывает воду, т.е. обезвоживает коллоидные частицы белка, вызывая дегидратацию мицелл белка, нарушение гидрофобных взаимодействий внутри белковой молекулы и вызывают ее денатурацию, что приводит к снижению растворимости и выпадению денатурированного белка в осадок.
Ход работы
К 5 каплям раствора белка прибавить 15-20 капель этилового спирта. Раствор мутнеет. Добавить 1 каплю насыщенного раствора хлористого натрия. При стоянии выпадает осадок белка. Результаты опыта оформляют в виде таблицы (2).
Проделайте опыты , сделайте выводы по каждому из них .
Выводы:
1) о механизме осаждения белков при кипячении;
2) о влиянии концентрации водородных ионов и ионов солей на устойчивость в растворе молекул денатурированного при кипячении белка;
Контрольные вопросы
Чем обусловлены реакции осаждения белков?
При каких температурных условиях возможно осаждение белков?
Что такое денатурация белков? Чем она может быть вызвана?







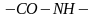 в белке.
в белке. 









