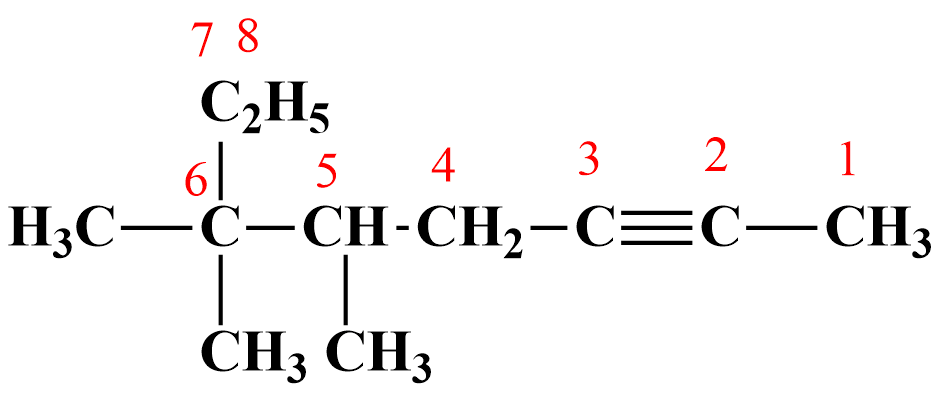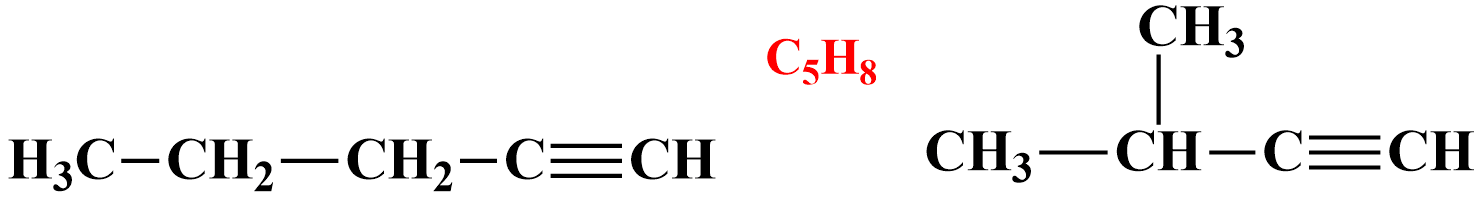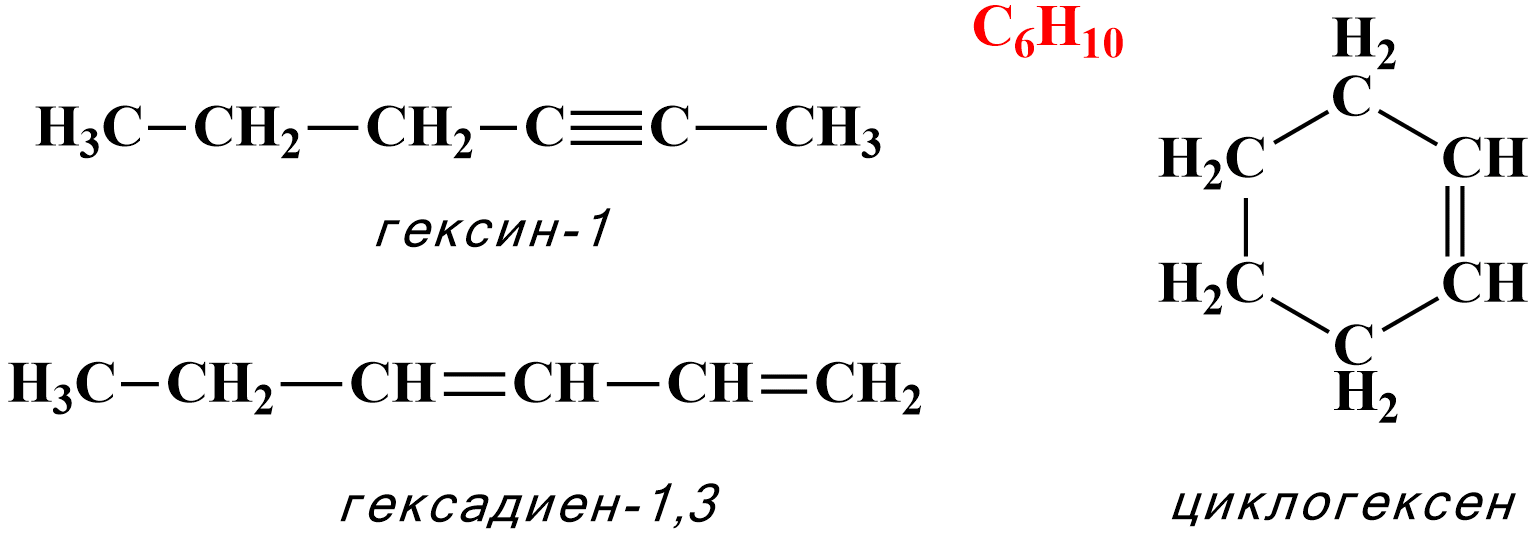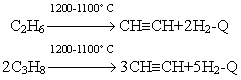Добрый день, уважаемые студенты!
Высылаю Вам лекцию по химии.
Лекцию необходимо законспектировать в тетрадь, после того, как лекция будет законспектирована, нужно пройти тест по прошлой лекции, перейдя по ссылке
https://multiurok.ru/tests/77773/
Тест необходимо пройти сегодня ,100% всем, до 18:00.
Тест по двум предыдущим лекциям «Алкены» и «Алкадиены»
Время выполнения ограничено – 16 минут. Критерии оценки: оценка "5"- 90% правильных ответов и более, оценка "4"- 70% - 89% правильных ответов, оценка "3" - 50% - 69% правильных ответов, оценка "2" - менее 50% правильных ответов.)
Для прохождения теста вам необходимо ввести фамилию и имя, и номер группы.
P.S. C уважением к вам, Татьяна Альбертовна!
22.04.2020 г.
АЛКИНЫ
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле CnH2n−2.
Номенклатура алкинов
Простейшим представителем данного класса является этина (или ацетилен) C2H2. Гомологический ряд алкинов представлен в таблице:
| Формула | Название | | Формула | Название |
| C2H2 | этин (ацетилен) | | C6H10 | гексин |
| C3H4 | пропин | | C7H12 | гептин |
| C4H6 | бутин | | C8H14 | октин |
| C5H8 | пентин | | C9H16 | нонин |
| | | | C10H18 | децин |
| Общая формула CnH2n−2 |
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а месторасположение связи в цепи — номером атома углерода.
При составлении названий алкинов:
выбирают главную цепь, содержащую максимальное количество атомов углерода и обязательно с наличием в ней тройной связи. Нумерацию начинают с того атома углерода, который расположен ближе к тройной связи. На рисунке самая длинная цепь содержит 8 атомов С, следовательно корень в названии будет окт-;
перед названием цепи перечисляют все заместители с указанием номера атома углерода, при котором они стоят, причем цифры, обозначающие месторасположение атомов, указывают в порядке возрастания: 5,6,6-триметил-;
после корня названия используют суффикс -ин, после которого указывают положение тройной связи. В данном соединении тройная связь расположена между 2-ым и 3-им атомами, поэтому: 5,6,6,-триметилоктин-2.
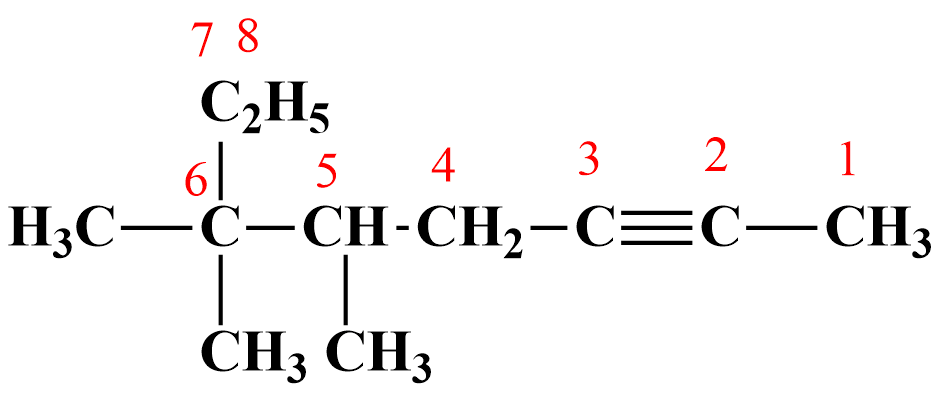
Физические свойства алкинов
Физические свойства алкинов похожи на свойства алканов и алкенов. Свойства некоторых представителей ряда алкинов представлены в таблице:
| Название (систематическая номенклатура) | Название (заместительная номенклатура) | Структурная формула | Tпл., град С | Ткип., град С |
| этин | ацетилен | HC≡CH | -81,8 | -84,0 |
| пропин | метилацетилен | HC≡C−CH3 | -101,5 | -23,2 |
| бутин-1 | этилацетилен | HC≡C−CH2−CH3 | -125,7 | +8,1 |
| бутин-2 | симм. метилацетилен | CH3−C≡C−CH3 | -32,3 | +27,0 |
| пентин-1 | пропилацетилен | HC≡C−CH2−CH2−CH3 | -90,0 | +40,2 |
| пентин-2 | метилэтилацетилен | CH3−C≡C−H2−CH3 | -101,0 | +56,1 |
| гексин-1 | бутилацетилен | HC≡C−(CH2)3−CH3 | -131,9 | +71,3 |
Как видно из таблицы, этин, пропин и бутин являются газами. При обычных условиях , (C5 – C16) — жидкости, начиная с C17 — твердые вещества. По мере увеличения числа атомов углерода в цепи температуры кипения жидких алкинов увеличиваются, а температуры плавления уменьшаются. В целом, температуры кипения алкинов выше, чем у соответствующих алкенов.
Алкины имеют специфический запах. Сам ацетилен обладает наркотическими свойствами. Алкины лучше растворяются в воде, чем алканы и алкены, однако растворимость все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях.
Изомерия алкинов
1. Для алкинов, так же как и для алкенов, характерна структурная изомерия:
изомерия углеродного скелета
изомерия положения кратной связи.
Простейший алкин, для которого характерна изомерия положения кратной связи, — это бутин:
HC≡C−CH2−CH3 CH3−C≡C−CH3
бутин-1 бутин-2
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
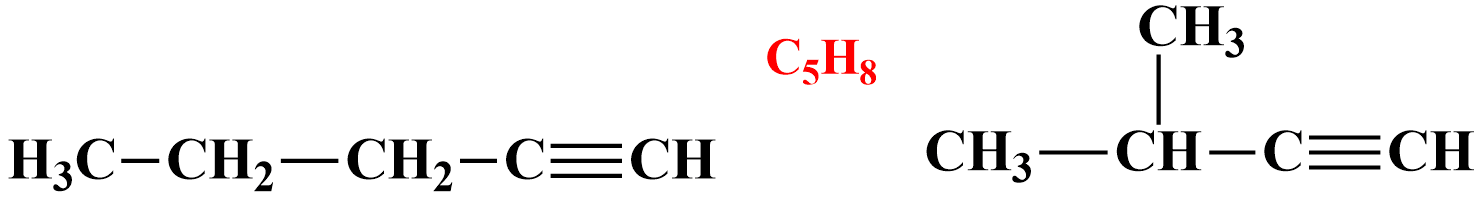
пентин-1 2-метилбутин-1
2. Для алкинов характерна межклассовая изомерия с некоторыми другими классами углеводородов, отвечающими той же общей формуле CnH2n−2, например с диенами и циклоалкенами:
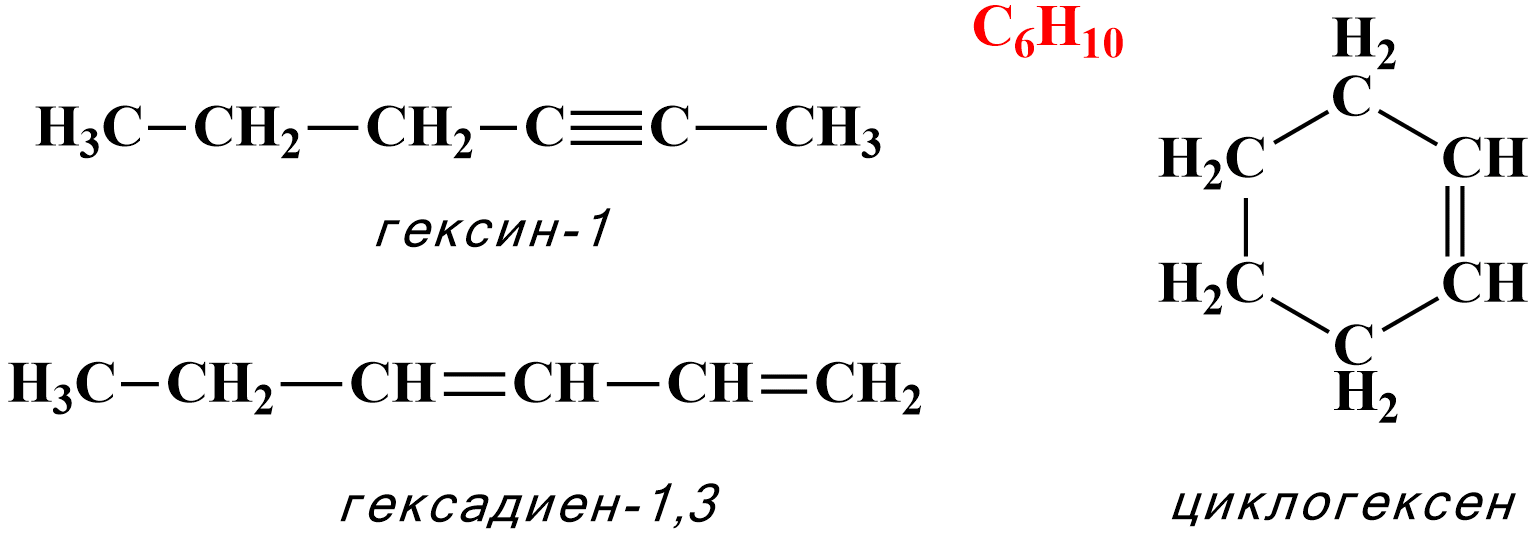
Геометрическая (цис/транс-) изомерия в случае алкинов невозможна, так как молекулы с тройной связью имеют линейное строение углеродной цепи.
Химические свойства алкинов
Алкины относятся к непредельным (ненасыщенным) соединениям, то есть их химические свойства обусловлены наличием в молекулах тройной связи, поэтому алкины преимущественно вступают в реакции электрофильного присоединения AE. Этот механизм подробно разбирается в теме "Типы и механизмы реакций в органической химии".
Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами. Рассмотрим подробнее типы этих реакций.
Реакции присоединения
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома), при этом реакция протекает в две стадии (первая - медленная, вторая - быстрая):
HC≡CH+Cl2⟶ClHC=CHCl
ClHC=CHCl+Cl2⟶Cl2HC−CHCL2
Реакции протекают при обычных условиях без присутствия катализатора. Поэтому алкины, так же, как и алкены, обесцвечивают бромную виду (качественная реакция на кратную связь).
2. Гидрогалогенирование (присоединение галогеноводорода).
Реакция присоединения галогеноводорода к несимметричным алкинам, в соответствии с электрофильным механизмом, протекает в две стадии, причем на обеих стадиях выполняется правило Марковникова, поэтому преимущественно образуются 2,2-дигалогеналканы:
1 стадия - (образование 2-бромпропена):
CH3—C≡CH+HBr⟶CH3—CBr=CH2
2 стадия - (образование 2,2-дибромпропана)
CH3—CBr=CH2+HBr⟶CH3—CBr2—CH3
Реакции протекают в присутствии катализаторов - кислот Льюиса (AlCl3,FeCl3,HgCl2). Реакции галогенирования и гидрогалогенирования используются при промышленном производстве тетрахлорэтилена, трихлорэтилена, винилхлорида и др. хлорсодержащих соединений.
3. Гидратация (присоединение воды) алкинов.
Большое значение для промышленного синтеза кетонов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова. Реакцию проводят в присутствии солей ртути (II). В результате реакции на первой стадии происходит присоединение молекулы воды в соответствии с правилом Марковникова и образуется промежуточный неустойчивый продукт - енол, то есть непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. В момент образования енолы изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом π-связь между атомами углерода разрывается, и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.
Конечными продуктами гидратации ацетилена является уксусный альдегид, а других замещенных алкинов - кетоны:
изомеризацияCH≡CH+H2O→Hg2+H2SO4[H−C(OH)=CH2]→изомеризацияH−C(=O)−CH3
Реакции полимеризации
1. Димеризация
В присутствии катализаторов алкины могут реагировать друг с другом, причем, в зависимости от условий, образуются различные продукты. Так, под действием солей одновалентной меди CuCl в водном растворе NH4Cl ацетилен димеризуется, образуя винилацетилен:
HC≡CH+HC≡CH⟶HC≡C−CH=CH2
Винилацетилен обладает большой реакционной способностью: присоединяя хлороводород, он образует хлоропрен:
HC≡C−CH=CH2+HCl⟶H2C=CCl−CH=CH2
который при полимеризации образует искусственный каучук:
nH2C=CCl−CH=CH2⟶(…−H2C−CCl=CH−CH2−…)n
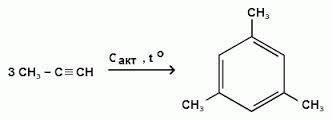
2. Тримеризация
При пропускании ацетилена над активированным углем при 6000C образуется смесь продуктов, одним из которых является бензол. Таким образом, бензол является продуктом тримеризации - присоединения и одновременной циклизации, прохтекающей через образование неустойчивого переходного комплекса:
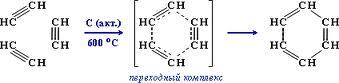
Эта реакция лежит в основе подтверждения количественного и качественного состава молекулы бензола. В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например - пропин. В этом случае при тех же условиях в результате тримеризации образуется 1,3,5-триметилбензол:
Окисление алкинов
1. Горение (жесткое окисление)
Ацетилен и другие алкины горят в кислороде с выделением очень большого количества теплоты, то есть реакция является экзотермической:
2C2H2+5O2⟶4CO2+2H2O +2600кДж
Восстановление алкинов
В присутствии металлических катализаторов (никеля) алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
HC≡CH+H2→NiH2C=CH2→NiH3C−CH3
При использовании платинового катализатора алкины восстанавливаются лишь до алкенов:
HC≡CH+H2→PtH2C=CH2
Получение и применение алкинов
Дегидрирование этана и этилена. Термическое дегидрирование этана при 550-650 °С приводит к образованию этилена, при температурах свыше 800 °С - ацетилена. Процесс дегидрирования этана подчиняется тем же закономерностям, что и пиролиз, поэтому для его осуществления необходимо поддерживать высокую температуру и низкое давление.
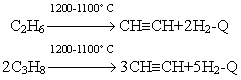
ПРИМЕНЕНИЕ АЛКИНОВ
Алкины являются сырьем для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинил-хлорида и других полимеров. Наиболее широко используется ацетилен:

Помимо применения в промышленности, ацетилен также применяют в газовых ацетиленовых горелках в смеси с кислородом. Температура ацетиленового пламени может достигать 30000C, поэтому такие горелки используют для сварки и резки металлов.