
История вещества.
Во время 1 Мировой войны английский крейсер вел преследование поврежденного в бою немецкого эсминца.
Цель была почти достигнута, как вдруг между кораблями появилось белое удушливое облако дыма. Экипаж крейсера почувствовал резкий запах, раздражающий горло и легкие. Крейсер должен был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Что же это было за едкое облако и какой газ почувствовали люди?

Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году , который назвал его «щелочной воздух» . Своим названием обязан оазису Аммона в Северной Африке , расположенному на перекрестке караванных путей. В жарком
климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону . Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.

Практическая работа № 4
Тема: Получение аммиака и изучение его свойств .
NH 3

Цель урока :
Получить аммиак и ознакомиться с его свойствами .
Задания.
- Получить аммиак по реакции гидроксида кальция с хлоридом аммония.
2. Изучите некоторые физические свойства аммиака (цвет, запах , растворимость в воде).
3. Изучение взаимодействие аммиака с водой, соляной кислотой.
4. Распознавание аммиака.

Техника безопасности.
- Соблюдайте правила техники безопасности при проведении опытов!
- Приступать к эксперименту можно только с разрешения учителя.
- Обо всех неполадках в работе оборудования или других сложностях ученики должны сообщить немедленно учителю и прекратить работу.
- Нельзя оставлять без присмотра спиртовку. Во время урока надо соблюдать правила пожарной безопасности .
- Осторожно обращаться с кислотами.!
- После занятий на уроке химии учащийся должен привести в порядок рабочее место, а также сдать оборудование и реактивы.
- После работы необходимо тщательно вымыть руки с мылом.
- При отравлении аммиаком необходимо обильное питье, затем стакан растительного масла, молока или лимонного сока.
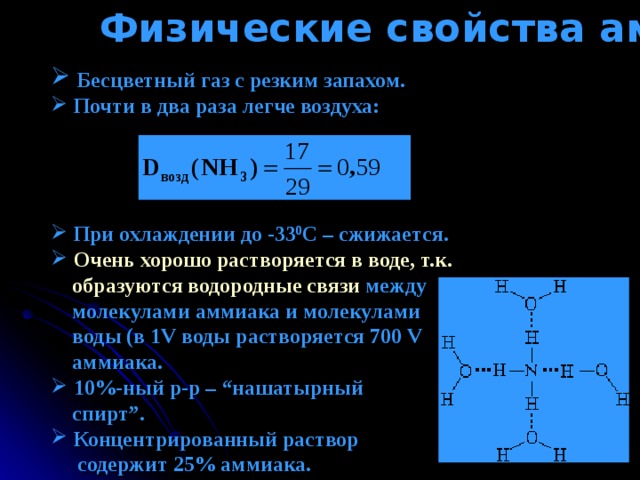
Физические свойства аммиака
- Бесцветный газ с резким запахом.
- Почти в два раза легче воздуха:
- При охлаждении до -33 0 С – c жижается.
- Очень хорошо растворяется в воде, т.к.
образуются водородные связи между
молекулами аммиака и молекулами
воды (в 1 V воды растворяется 700 V
аммиака.
- 10%-ный р-р – “ нашатырный
спирт ” .
- Концентрированный раствор
содержит 25% аммиака.

Способы получения аммиака
В промышленности:
N 2 + 3H 2 2NH 3
Реакция проводится при нагревании, под давлением,
в присутствии катализатора.
В лаборатории:
- Действием щелочей на соли аммония:
2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3

Получение аммиака в промышленности

Химические свойства аммиака
-3
NH 3 – низшая степень окисления азота.
1. Аммиак - восстановитель
4NH 3 + 3O 2 = 2N 2 + 6H 2 O
- Каталитическое окисление аммиака:
4NH 3 + 5O 2 = 4NO + 6H 2 O
- Аммиаком можно восстановить некоторые
неактивные металлы:
3CuO + 2 NH 3 = 3Cu + N 2 + 3H 2 O

II. Основные свойства аммиака:
- При растворении аммиака в воде образуется
гидрат аммиака, который диссоциирует:
NH 3 + H 2 O NH 3 H 2 O NH 4 + + OH -
ион аммония
Изменяет окраску индикаторов :
Фенолфталеин – б / цв малиновый
Метилоранж – оранжевый желтый
Лакмус – фиолетовый синий
- С кислотами образует соли аммония:
NH 3 + HCl = NH 4 Cl хлорид аммония
2NH 3 + = (NH 4 ) 2 SO 4 сульфат аммония
NH 3 + H 2 SO 4 = NH 4 HSO 4 гидросульфат аммония

Применение аммиака
Хладоагент в
промышленных
холодильных
установках
Получение
соды
Производство
лекарств
Производство
фотопленки и
красителей
Аммиак
Окислитель
ракетного
топлива
Азотная кислота
Обработка
драгоценных
металлов
Соли
аммония
для
паяния
Азотные
удобрения
Аммиачнаяселитра Ca(NO 3 ) 2
Сульфат аммония (NH 4 ) 2 SO 4
Хлорид аммония NH 4 Cl
Карбамид (мочевина) CO(NH 2 ) 2
Аммиачная вода NH 3 H 2 O
Жидкий аммиак NH 3
Производство
взрывчатых
веществ

Рефлексия
Сегодня на уроке я:
☼ Научился…
☼ Мне показалось важным…
☼ Я понял, что…
Своей работой на уроке я:
♦ Доволен…
♦ Не совсем доволен…
♦ Я не доволен, потому что….





























