Просмотр содержимого документа
«Применение кислорода»

ХИМИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ КИСЛОРОДА

Химические свойства – способность
веществ превращаться в другие под
воздействием определенных условий:
при изменении температуры, давления
и т. д.

ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Взаимодействие веществ с кислородом называется
окислением или горением .
2 Mg + O 2 2 MgO
2Cu + O 2 2CuO
3 Fe+2 O 2 Fe 3 O 4
с неметаллами
с металлами
C + O 2 CO 2
S + O 2 SO 2
2H 2 + O 2 2H 2 O
со сложными веществами
4 FeS 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2
2H 2 S + 3O 2 2SO 2 + 2H 2 O
CH 4 + 2O 2 CO 2 + 2H 2 O

- Кислород – сильный окислитель.
- С кислородом реагируют все элементы, кроме Au , Pt , He , Ne и Ar .
- В результате взаимодействия веществ с кислородом образуется оксиды .
- Оксиды – сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
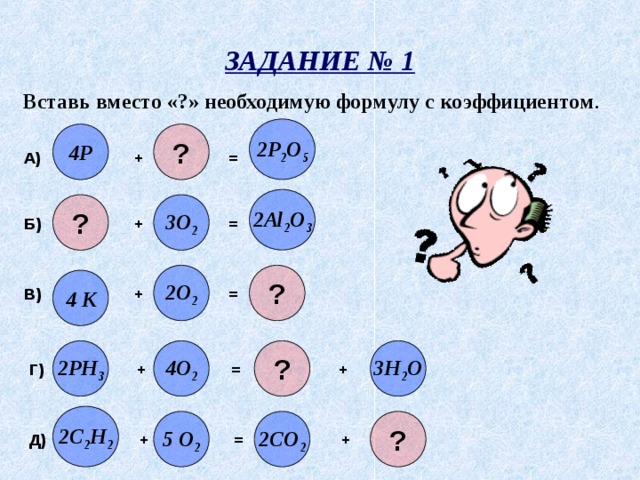
ЗАДАНИЕ № 1
Вставь вместо «?» необходимую формулу с коэффициентом .
2P 2 O 5
?
4P
А) + =
2Al 2 O 3
?
3O 2
Б) + =
2O 2
?
4 K
В) + =
?
2PH 3
4O 2
3H 2 O
Г) + = +
2C 2 H 2
5 O 2
2CO 2
?
Д) + = +

ОТВЕТЫ К ЗАДАНИЮ № 1
Вставь вместо «?» необходимую формулу с коэффициентом .
2P 2 O 5
5 O 2
4P
А) + =
2Al 2 O 3
3O 2
4 Al
Б) + =
O 2
2К 2 О
4 K
В) + =
Р 2 О 5
3H 2 O
4O 2
2PH 3
Г) + = +
2C 2 H 2
5 O 2
4 CO 2
2Н 2 О
Д) + = +
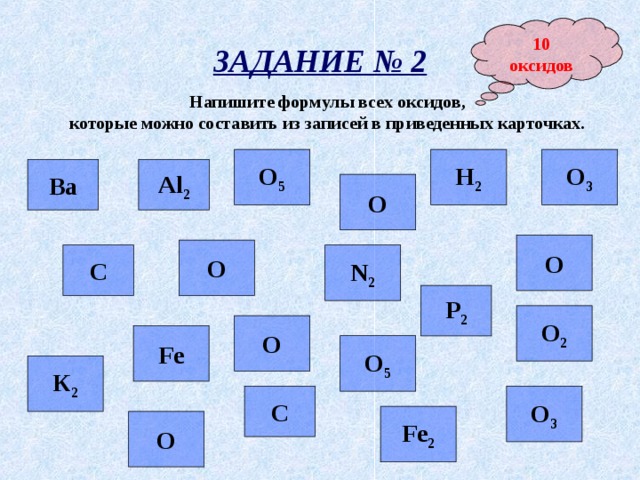
10
оксидов
ЗАДАНИЕ № 2
Напишите формулы всех оксидов,
которые можно составить из записей в приведенных карточках.
Н 2
О 3
О 5
Al 2
Ва
О
О
О
N 2
С
Р 2
О 2
О
Fe
О 5
К 2
С
О 3
Fe 2
О

ОТВЕТЫ К ЗАДАНИЮ № 2
О
Ва
О
Н 2
О 3
Al 2
N 2
О 5
О 2
С
Р 2
О 5
С
О
О
Fe
О
К 2
Fe 2
О 3

НАХОЖДЕНИЕ КИСЛОРОДА В ПРИРОДЕ
Он всюду и везде:
В камне, в воздухе, в воде.
Он и в утренней росе,
И в небес голубизне.
Литосфера - 47% по m (в составе оксидов, солей)
Гидросфера - 85,8% (в основном в составе воды )
Атмосфера - 23% по m, 21% по V
Растения - 40%
Животные - 20%
Тело человека - 65%
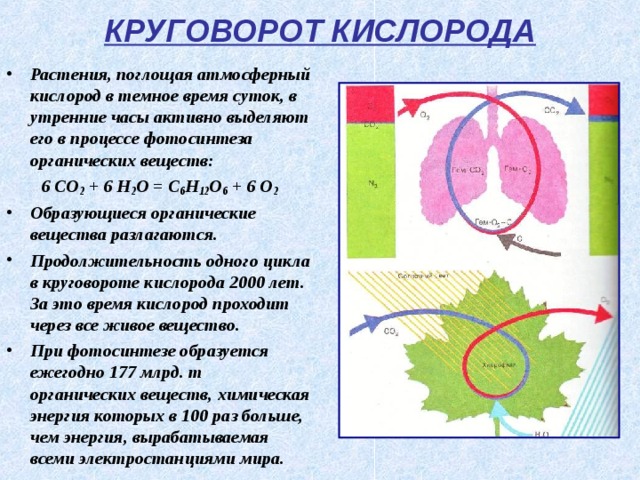
КРУГОВОРОТ КИСЛОРОДА
- Растения, поглощая атмосферный кислород в темное время суток, в утренние часы активно выделяют его в процессе фотосинтеза органических веществ:
6 CO 2 + 6 H 2 O = C 6 H 12 O 6 + 6 O 2
- Образующиеся органические вещества разлагаются.
- Продолжительность одного цикла в круговороте кислорода 2000 лет. За это время кислород проходит через все живое вещество.
- При фотосинтезе образуется ежегодно 177 млрд. т органических веществ, химическая энергия которых в 100 раз больше, чем энергия, вырабатываемая всеми электростанциями мира.

ПРИМЕНЕНИЕ КИСЛОРОДА
- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.


ДОМАШНЕЕ ЗАДАНИЕ
- § 20, 21
- упр. 4—12,
- задачи 2, 3 (с. 60)






























