Урок
Теория электролитической диссоциации (11 класс)
Цель урока:
Сформировать основные понятия: электролиты, неэлектролиты, электролиты диссоциации, катионы, анионы.
Задачи-
Дать представление о механизации электролитической диссоциации.
Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
Обучать аргументировано защищать свою точку зрения.
Развитие коммуникативных способностей.
Оборудование: прибор для проверки проводимости водных растворов электролитов.
Водные растворы: дистиллированная вода, кристаллы поваренной соли, раствор HCl, раствор щелочи, водный раствор спирта.
План урока:
I.Стадия «Вызова»
1) Вступление
Мы приступаем к изучению проводимости растворов некоторых классов веществ. Электрический ток в металлах и растворах некоторых веществ вы изучали в курсе физики. Новый материал запоминается легче, если он уже вам знаком. Поэтому сейчас предстоит работа с изучением этого материала из памяти.
2. а) Стадия «Вызова»
Расчертите листок на три части и подпишите графы.
В течение 5-ти минут каждый из вас заполнит графу, отвечая на вопросы: смотри приложение 1.
Приложение 1.
Электрический ток в металлах и в растворах щелочей, кислот, солей.
Прочти следующие вопросы:
На какие частицы распадаются при растворении в воде вещества?
Какие два рода электрических зарядов существуют в природе?
На какие две группы делятся вещества по способности проводить электрические заряды?
Что представляет собой электрический ток водных растворов солей, кислот, щелочей?
Как называют растворы этих веществ?
Как возникают заряженные частицы в водном растворе этих веществ?
Б) перескажите друг другу ваши записи(15 минут)
В) выделите ключевые понятия по теме «Электрический ток» в электролитах и в растворах щелочей, кислот, солей.
Г) какая информация у вас осталась не полной?
Заполните вторую графу таблицы «хочу узнать»
Как правило, примерно 75-80% учащихся признают, что открытие вопроса остается на пункте №6.
Как возникают заряженные частицы в одном растворе этих веществ?
Возникает еще одна проблема - откуда у веществ с молекулярной решеткой в растворе появляются ионы.
Демонстрация опыта и заполнение таблицы приложение №2.
Приложение 2
Исследовать электрическую проводимость веществ с различным типом связи
Инструкция
Внимательно прочитайте задание и цель исследования.
Систематизируйте вещества по характеру химической связи и типу кристаллической решетки.
Выскажите предложения, какие из исследуемых веществ при растворении в воде будут распадаться на молекулы, а какие на ионы.
Пронаблюдайте опыт.
Результаты опыта сформулируйте в виде таблицы.
II стадия «Осмысления»
Опорный конспект
Электролиты - вещества, приводящие в растворенном гели расплавленном состоянии электрический ток, вследствие распада их на ионы. Примеры электролитов: соли, кислоты. В этих веществах имеется ионная или ковалентная сильнополярная связь.
Неэлектролиты - вещества, водные растворы которых не проводят электрический ток. К таким веществам относят кислород, водород, сахар, глицерин. Для них характерна ковалентная неполярная или малополярная связь. Процесс распада электролитов на ионы при растворении его в воде или расплавление называется электрической диссоциацией. Для правильного понимания механизма растворения в воде веществ следует учесть строение молекулы воды и вид связи растворяемого вещества.
В молекулах воды между атомами водорода и кислорода имеются ковалентные сильнополярные связи. Поэтому молекулы воды полярны:
+-
диполь.
Вследствие этого, например, при растворении хлорида натрия молекулы H2O притягиваются отрицательными полюсами к положительно заряженным ионам атомам кристаллической решетки, а положительными к отрицательно заряженным ионам натрия. Такой процесс называется гидратацией, он идет с выделением энергии. Энергия гидратации приводит к разрушению кристаллической решетки и вещество распадается на ионы.
Притяжение и действие полярных молекул воды на кристаллическую решетку хлорида натрия.
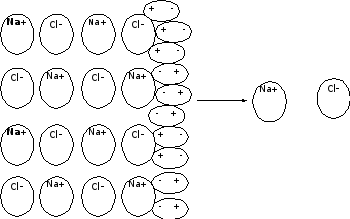
Na
+
При растворении в воде веществ с ковалентной сильнополярной связью, например HCl происходит изменение характера химической связи, т.е под влиянием энергии гидратации ковалентная связь превращается в ионную и далее процесс протекает как у веществ с ионной связью.
При расплавлении электролитов усиливается колебательные движения частей, приводит к ослаблению связи между ними. В результате также разрушается кристаллическая решетка и образуются ионы.
В растворе и расплаве электролита ионы движутся хаотически.
Идет работа с текстом и его маркировка, учащимся предлагается по ходу текса вставить следующие знаки:
V- уже известно
+-абсолютно новое, неожиданное
- -противоречит твоим представлениям
? – хочется узнать что-то больше
На данной стадии идет соотношение уже известного с тем «что узнал». Происходит структурная организация информации в памяти, можно спросить у учащихся какие у них были знаки?
III Стадия «размышления» рефлексия.
Учащиеся должны попробовать выразить информацию, которую получили своими словами (работа с графой №3 таблица «что узнал?»
1.Выянили, какие новые понятия они увидели в тексте (эти понятия записываем в 3-ю колонку)
2.рассказать о механизме диссоциации веществ с ионным типом связи.
3.Рассказать о механизме диссоциации веществ с ковалентным типом связи.
Домашнее задание -
выучить понятия, знать механизм диссоциации.
Ответить на вопрос-
процесс растворения физический или химический. Подобрать доказательства в пользу каждого процесса.


















