
Раздел
Основы
электродинамики
Глава 16
Электрический
ток
в различных средах
11
класс
Урок
4
ФИЗИКА
Учись, ибо в превратностях жизни
только знания останутся всегда с тобой.
Насир Хосров
таджикский и персидский поэт

Физический диктант
1 . Что называют электрическим током?
2. Какие условия необходимы для существования электрического тока?
3.Перечислите необходимые условия для существования электрического тока в металлах.
4. Что называют электрическим током в металлах?
5.Чем обусловлена электропроводность металлов?
6.Какова зависимость тока в проводнике от напряжения?

Задание № 1
Электрическим током называют упорядоченное (направленное) движение заряженных частиц
+
За направление тока принимают направление движения отрицательно заряженных частиц
-
Заряд, перенесенный в единицу времени, служит основной количественной характеристикой тока и называется силой тока
+
Если сила тока со временем не меняется, то ток называют переменным
-
Сила тока – величина векторная
-
Сила тока может быть как положительной, так и отрицательной
+
Для возникновения и существования постоянного электрического тока в веществе необходимо наличие свободных заряженных частиц
+
Для создания и поддержания упорядоченного движения заряженных частиц необходима сила, действующая на них в определенном направлении
+
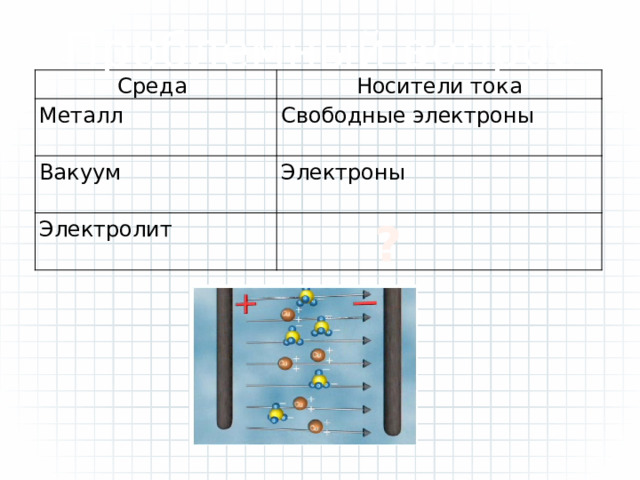
Проблемный вопрос
Среда
Носители тока
Металл
Свободные электроны
Вакуум
Электроны
Электролит
?
Э лектрический ток
в жидкостях

Сегодня на уроке
Жидкости – проводники или диэлектрики?
Электролитическая диссоциация
Электролиз и его законы
Применение электролиза

Задание: используя материал учебника, заполните таблицу, то есть составьте план-тезис
План
Тезис
1. Электролиты
2. Электролитическая диссоциация
3. Степень диссоциации
4. Рекомбинация
5. Электролиз
6. Закон электролиза
7. Электрохимический эквивалент вещества
8. Применение электролиза
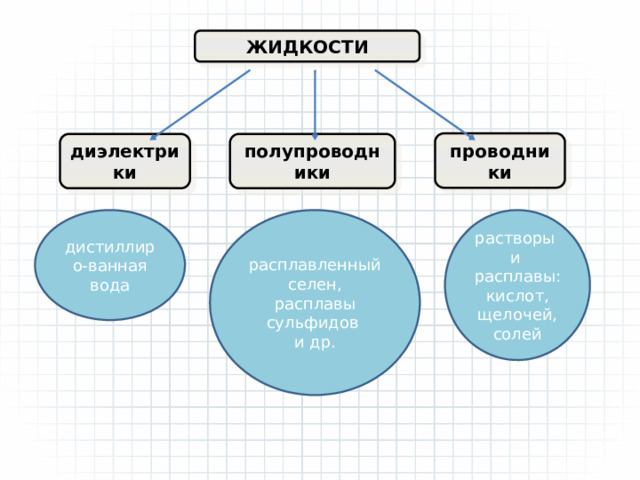
ЖИДКОСТИ
проводники
диэлектрики
полупроводники
расплавленный селен, расплавы сульфидов
дистиллиро-ванная вода
и др.
растворы
и
расплавы: кислот,
щелочей,
солей

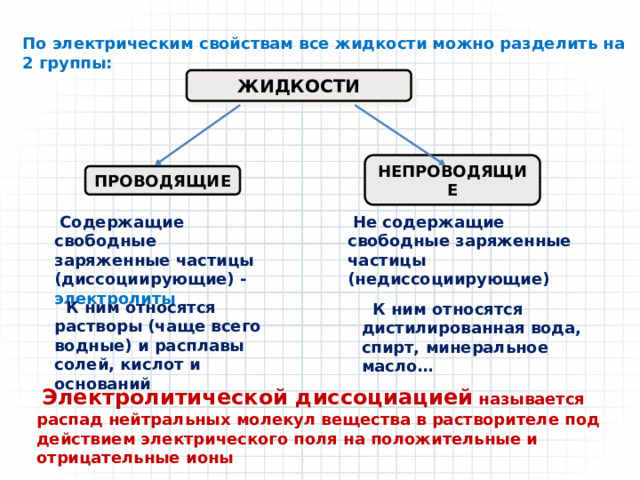
По электрическим свойствам все жидкости можно разделить на 2 группы:
ЖИДКОСТИ
НЕПРОВОДЯЩИЕ
ПРОВОДЯЩИЕ
Содержащие свободные заряженные частицы (диссоциирующие) - электролиты
Не содержащие свободные заряженные частицы (недиссоциирующие)
К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований
К ним относятся дистилированная вода, спирт, минеральное масло…
Электролитической диссоциацией называется распад нейтральных молекул вещества в растворителе под действием электрического поля на положительные и отрицательные ионы

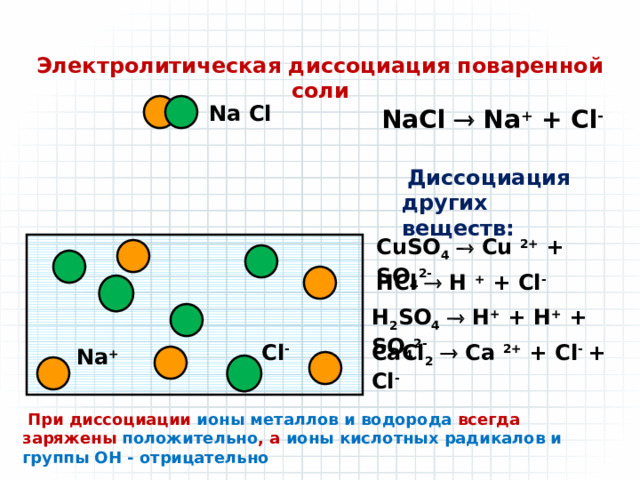
Электролитическая диссоциация поваренной соли
Na Cl
NaCl Na + + Cl -
Диссоциация других веществ:
CuSO 4 Cu 2+ + SO 4 2-
HCl H + + Cl -
H 2 SO 4 H + + H + + SO 4 2-
CaCl 2 Ca 2+ + Cl - + Cl -
Cl -
Na +
При диссоциации ионы металлов и водорода всегда заряжены положительно , а ионы кислотных радикалов и группы ОН - отрицательно

Степень диссоциации – доля в растворенном веществе молекул,
распавшихся на ионы.
От чего зависит степень диссоциации?
- от температуры
- концентрации раствора
- электрических свойств растворителя

Если температуру вещества увеличить.
Что будет происходить?
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы
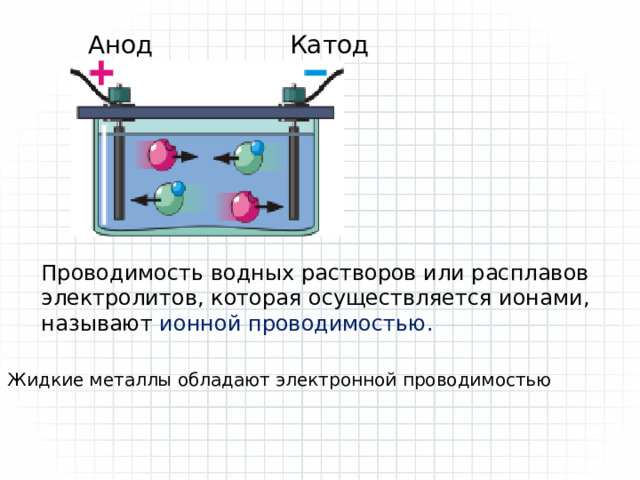
Анод
Катод
Проводимость водных растворов или расплавов электролитов, которая осуществляется ионами, называют ионной проводимостью.
Жидкие металлы обладают электронной проводимостью
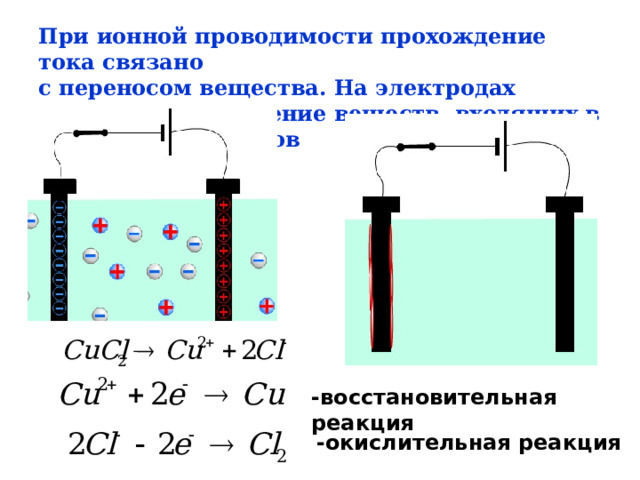
При ионной проводимости прохождение тока связано
с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов
- восстановительная реакция
- окислительная реакция
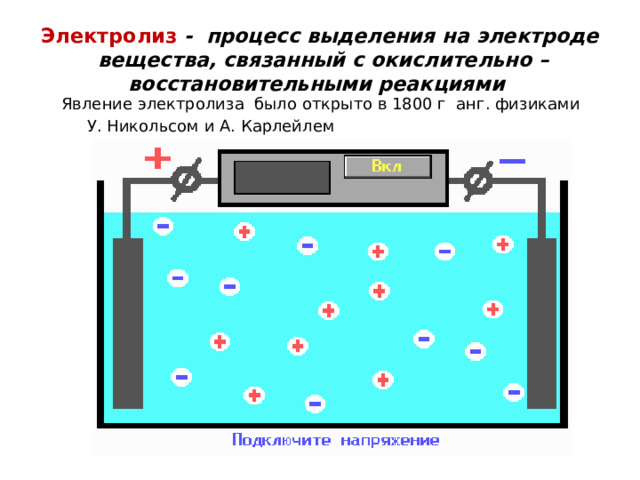
Электролиз - процесс выделения на электроде вещества, связанный с окислительно – восстановительными реакциями
Явление электролиза было открыто в 1800 г анг. физиками
У. Никольсом и А. Карлейлем


Открыт в 1833 г. анг. физиком Майклом Фарадеем
От чего зависит масса вещества, выделившегося на электродах за определённое время? Закон электролиза (Закон Фарадея)

Масса вещества, выделившегося на электроде за время Δt при прохождении электрического тока, прямо пропорциональна силе тока и времени
ᵏ – электрохимический эквивалент вещества (зависит от молярной массы вещества «М» и валентности «n»)
Физический смысл k – численно равен массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл

- постоянная Фарадея
F= 9,65 *10 4 Кл/моль
Физический смысл F- численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества


Применение электролиза
● Для получения щелочных, щелочноземельных металлов, алюминия, лантаноидов
● Для получения точных металлических копий, что называется гальванопластикой
● Для защиты металлических изделий от коррозии и для придания
декоративного вида.
Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется гальваностегией
● Очистка металлов от примесей
● Получают электронные платы, служащие основой всех электронных изделий

Применение электролиза в технике:
- Гальваностегия- декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение).
- Гальванопластика- электролитическое изготовление металлических копий, рельефных предметов. Этим способом были сделаны фигуры для Исаакиевского собора в Санкт-Петербурге.
- Электрометаллургия-получение чистых металлов при электролизе расплавленных руд (Al, Na, Mg, Be).
- Рафинирование металлов- очистка металлов от примесей.
- Полиграфия – печатная промышленность

Алмазный инструмент,
изготовленный методом
гальваностегии
гальваническое наращивания тонкого слоя

Венцы, чеканка, камни, золочение

Повторим
Чистая вода является диэлектриком. Однако водный раствор NaCl является проводником потому, что…
А. При растворении соли вода нагревается и ионизируется.
Б. При взаимодействии с солью молекулы воды распадаются на ионы водорода и кислорода.
В. В растворе от молекулы NaCl отрываются электроны и переносят заряд.
Г. После растворения соли молекулы NaCl переносят заряды.
Д. Соль в воде распадается на ионы Na + и Cl - .

1.Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока.
2. Катод – отрицательно заряженный электрод;
3. Анод - отрицательно заряженный электрод;
4. Степень диссоциации не зависит от концентрации раствора;
5. Ион Cu 2 + будет восстанавливаться на катоде в водном растворе;
6. Электрическая диссоциация – это распад молекул на электроны;
7. Проводимость водных растворов или расплавов электролитов – электронная
8. k - диссоционный эквивалент
Ответы: 1, 2, 5 ( да)

Опора для мысли Запомни!
Рефлексия

Все люди от природы стремятся к знанию. Наиболее достойны познания первоначала и причины, ибо через них и на их основе познаётся всё остальное
Аристотель

Пора делать выводы
Продолжить фразу:
1.Мне было интересно…
2.Мы сегодня разобрались….
3.Я сегодня понял, что…
4.Мне было трудно…
5.Завтра я хочу на уроке…
























































