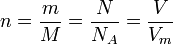|
|
|
|
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО РЕШЕНИЮ РАСЧЁТНЫХ
ЗАДАЧ ПО ХИМИИ

|
Автор учитель химии высшей категории Кальнова С.С.
Содержание:
Введение 4
Роль и место расчётных задач в курсе химии 6
Классификация задач 7
Задачи, решаемые с использованием
химической формулы вещества или на вывод
формулы. 8
Задачи, для решения которых используют уравнение химической реакции. 12
Задачи, связанные с растворами или смесями веществ 17
Справочные данные 23
Литература 27
Введение
Настоящие методические указания являются логическим продолжением методических указаний к выполнению самостоятельной подготовки обучающихся к занятиям, выполнению практических и контрольной работы по химии. Примеры решения задач совпадают с выполнением лабораторной работы по теме «Приготовление растворов с заданной концентрацией» и предложенными задачами в каждой изученной темы нового материала.
Главная цель настоящих методических указаний – помочь студентам решить различные типы задач при подготовке к занятиям, лабораторным и контрольным работам.
Настоятельно рекомендуем студентам предварительно изучить теоретический материал по каждому разделу химии, используя учебную литературу по химии. Весь теоретический материал с формулами, определениями и т. д. по каждому разделу, необходимый для решения задач, можно найти и в учебной литературе по химии.
Для удобства пользования в настоящих методических указаниях приведены справочные данные.
При рассмотрении примеров обратите внимание, что практически везде используется международная система единиц (СИ); все физические величины, где это требуется, даны с соответствующими единицами измерения; во всех расчетных формулах величины подставлены без преобразований в необходимых единицах измерения.
Очень надеемся, что данные методические указания помогут вам успешно справиться с решением задач по химии.
ЖЕЛАЕМ УСПЕХА!
Роль и место расчётных задач в курсе химии
Химическая учебная задача – это модель проблемной ситуации, решение которой требует мыслительных и практических действий на основе знания законов, теорий и методов химии, направленная на закрепление, расширение знаний и развитие химического мышления.
Значение решения задач:
Во-первых, это практическое применение теоретического материала, приложение научных знаний на практике.
Решение задач как средство контроля и самоконтроля развивает навыки самостоятельной работы; помогает определить степень усвоения знаний и умений и их использования на практике; позволяет выявлять пробелы в знаниях и умениях учащихся и разрабатывать тактику их устранения.
Во-вторых, прекрасный способ осуществления межпредметных и курсовых связей, а также связи химической науки с жизнью.
Место задач в курсе химии:
При объяснении нового материала задачи помогают иллюстрировать изучаемую тему конкретным практическим применением, в результате учащиеся более осознанно воспринимают теоретические основы химии.
Самостоятельное решение задач способствует привлечению студентов к самостоятельной работе с использованием не только учебников, но и дополнительной литературы.
Решение задач – это мыслительный процесс.
С целью контроля и учета знаний лучшим методом также является расчетная задача, т.к. при ее решении можно оценить все качества ученика, начиная от уровня знания теории до умения оформлять решение в тетради.
Итак, решение задач:
учит мыслить, ориентироваться в проблемной ситуации;
проявляет взаимосвязь представлений и понятий;
ведет к лучшему пониманию учащимися химических явлений в свете важнейших теорий;
позволяет установить связь химии с другими предметами, особенно с физикой и математикой;
является средством закрепления в памяти учащихся химических законов и важнейших понятий;
служит одним из способов учета знаний и проверки навыков, полученных в процессе учения предмета;
воспитывает в процессе изучения у учащихся умение использовать полученные знания для решения практических проблем, тем самым связывая обучение с жизнью и деятельностью человека.
Классификация задач На сегодняшний день не существует единого подхода к классификации химических задач. Окончательно разработанной классификации химических задач нет. В учебных пособиях по методике химии, специальных методических пособиях по решению задач и в статьях приводятся различные варианты классификации задач. Общепризнанной является классификация химических задач на качественные и количественные, которые решаются устным, письменным и экспериментальным способом:
Химические расчетные задачи можно условно разделить на три группы:
Задачи, решаемые с использованием химической формулы вещества или на вывод формулы.
Задачи, для решения которых используют уравнение химической реакции.
Задачи, связанные с растворами веществ.
Задачи, решаемые с использованием химической формулы вещества или на вывод формулы.
Задача 1. Сколько молекул озона О3 содержится в 72 г его?
| Дано: m(О3)= 72г | Решение 1) n (О3)=m/ M= 72г:48г/моль=1,5моль M(О3)=16.3= 48 г/моль 2) N (О3)=n NA= =1,5моль.6,02.1023молекул.моль-1=9.1023молекул Ответ: N (О3)= 9.1023молекул |
| Найти: N (О3)-? |
Задача 2. Какой объем занимают (при н.у.) 280 кг азота?
| Дано: m(N2) = 280кг | Решение n (N2)=m/ M= 280кг:28кг/ кмоль =10кмоль M (N2) = 14.2= 28 г/моль= 28кг/ кмоль V (N2)= n .Vм =10кмоль.22,4м3/ кмоль=224 м3 Ответ: V (N2)= 224 м3 |
| Найти: V (N2) -? |
Задача 3. Какую массу имеют 112л (при н.у.) углекислого газа?
| Дано: V (СО2) = 112л | Решение n (СО2)=V/ Vм = 112л/ 22,4л/моль= 5 моль m (СО2) = n.M= 5моль?(12+16.2) г/ моль= 5.44=220г Ответ: m (СО2) =220г |
| Найти: m (СО2)-? |
Задача 4. Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
| Дано:
w (О) = 42,67% | Решение:
Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH
w (О) =  M кислоты = 75 (г/моль) = 75 (г/моль)
Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75
14 n = 14, n = 1
Ответ: формула кислоты NН2CН2CОOH
М (NН2CН2 CОOH) = 75 г/моль |
| Вывести формулу соединения
CnН2n (N Н2) CОOH |
Задача 5. Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
| Дано:
m (вещ) = 9г
m (CO2) = 17,6г m (Н2О)= 12,6г
D (Н2) = 22,5
| Решение Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 Находим какое количество вещества С и Н находится в CO2 и H2O ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 * 2 = 1,4 моль. Находим массу азота в исходном веществе.Для этого из массы всего исходного вещества надо вычесть массы С и Н. m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 г Масса всего вещества 9,8 г. m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль. М (С2Н7N) = М истинной. Ответ: С2Н7N. |
| Вывести формулу соединения
CхНу- ? |
Примерные задачи:
Сколько молекул содержится в 11 г углекислого газа СО2?
Сколько молекул содержится в 1 кмоль вещества7
Найдите массу 15 * 1023 молекул кислорода
Определите массу 1,5 моль воды.
Найдите объём, который при н.у. займут 3г. Водорода.
Рассчитайте массу 5л. (н.у.) серной кислоты.
В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода равна 3, 45. Определите формулу углеводорода.
Массовая доля в углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Задачи, для решения которых используют уравнение химической реакции.
Задача 1..Вычислите массу кислорода, выделившегося в
результате разложения воды массой 9 г.
| Дано: m(H2O) = 9 г
m(О2) - ? М(H2O) = 18 г/моль М(O2) = 32 г/моль | Решение 1.Составим уравнение реакции. Над формулами веществ запишем найденные количества веществ, а под формулами – стехиометрические соотношения по уравнению реакции 0,5 моль х моль 2H2O = 2H2 + O2 2 моль 1 моль
2. Вычислим количество вещества кислорода. Для этого составим пропорцию. Следовательно, n(O2) = 0,25моль
Найдём массу кислорода, которую требуется вычислить. m = n · M m(O2) = 0,25 моль · 32г/моль = 8 г
Ответ: m(O2) = 8 г |
Задача 2. Вычислите объём водорода (н.у.), выделившегося при взаимодействии 40,5 г алюминия с раствором серной кислоты.
| Дано:
Дано: m(Al) = 40,5 г V(H2) - ? М(Al) = 27 г/моль Vm = 22,4 л/моль | Решение 1. Составим уравнение реакции. Над формулами веществ запишем найденные количества веществ, а под формулами – молярные соотношения по уравнению реакции 1,5 моль хмоль 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 2 моль 3моль
2. Вычислим количество вещества водорода. Для этого составим пропорцию Следовательно, n(H2) = 2,25 моль
3. Найдём массу водорода, которую требуется вычислить. V = n · Vm V(Н2) = 2,25 моль · 22,4 л/моль=50,4 л
Ответ: V(Н2) = 50,4 л. |
Задача 3. Рассчитайте объём хлороводорода,
образовавшегося при взаимодействии 7 л водорода с хлором.
| Дано: V(H2) = 7 л V(HСl) - ? | Решение. 1.Составим уравнение реакции. Над формулами веществ запишем данные об объёмах газообразных веществ, а под формулами – молярные соотношения по уравнению реакции, которые для газов, согласно закону Авогадро, равны их объёмным отношениям 7л х л H2 + Cl2 → 2HCl 1 моль 2 моль
2. Вычислим объём хлороводорода. Для этого составим пропорцию. Следовательно, V(HCl) = 14 л.
Ответ: V(HCl) = 14 л. |
Задача 4. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
| Дано: m(K2O) = 47 г,
m(HNO3) = 40 г.m(КNO3). Mr(K2O)= 94 Mr(HNO3) =63 Mr(KNO3) =101
| Решение 1. Составим уравнение реакции. Над формулами веществ запишем данные 47г 40г Хг K2O + 2HNO3 = 2KNO3+ H2O 1 моль 2 моль 2 моль 94г/моль 63г/моль 101г/моль 94г 126г 202г Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке. 47г К2О – Х г HNO3 94г К2О – 126 г HNO3 Х = 47* 126/94 = 63 2. Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3: 40г HNO3: - Х г KNO3 126г НNO3 - 202г KNO3 Х = 40 * 202/ 126 = 64г Ответ. m(КNO3) = 6г |
Примерные задачи:
1.Вычислите количество оксида алюминия, который образуется в результате сгорания 2,7 г порошка алюминия.
2. Рассчитайте массу сульфата натрия, который образуется при нейтрализации раствора, содержащего 80 г гидроксида натрия, раствором серной кислоты.
3. Вычислите объём (н. у.) и массу сернистого газа, который образуется при сгорании серы массой 8 г.
4. Вычислите объём водорода (н. у.), который образуется при взаимодействии 6,9 г натрия с водой.
5. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
6. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
7. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
8. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Задачи, связанные с растворами или смесями веществ.
Задача 1. На 200 г 10%-го раствора серной кислоты подействовали оксидом алюминия. Найдите массу образовавшейся воды.
| Дано: m(р-р H2SO4) = 200 г,
W(H2SO4) = 10%,
m(Al2O3) m(Н2O). Mr(H2SO4) = 98, Mr(H2O) = 18.
| Решение 1. Рассчитаем массу серной кислоты в растворе m(H2SO4) = 200•10/100 = 20 г. 2. Составим уравнение реакции. Над формулами веществ запишем данные m=20г m=Х 3H2SO4 + Al2O3 = Al2(SO4)3 +3Н2О 3 моль 3 моль М=98 М=18 m=294 m=54 3. Составляем пропорцию и решаем её. 20г H2SO4 – Х г Н2О 294г H2SO4 – 54 г Н2О Х = 20г* 54г/ 294г = 3,7 г Ответ. m(Н2O) = 3,7г. |
Задача 2 . Сколько граммов соли и воды нужно для приготовления 300г. 5% раствора?
| Дано: m(р-ра) = 300 г,
W(вещ-ва) = 5% m(Н2O) = ? m(соли) = ?
| Решение 1.Находим массу растворённого вещества, преобразовав формулу W(вещ-ва) = m(вещ-ва)/ m(р-ра) m(вещ-ва) = 5% * 300/100% = 15г.
2. Находим массу воды в растворе m(Н2O)= 300г – 15г = 285г Ответ. m(вещ-ва) = 15г., m(Н2O) = 285г.
|
Задача 3. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
| Дано: V(смеси) = 50мл, V(СО2) = 48,5 мл, V(N2) = 1,5 мл.  (CO2), (CO2),  (N2). (N2).
| Решение Рассчитаем объемную долю углекислого газа в смеси. По определению: 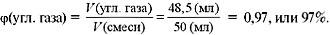 Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:  (угл. газа) + (угл. газа) +  (азота) = 100%, (азота) = 100%,  (азота) = 100% – (азота) = 100% –  (угл. газа) = 100% – 97% = 3%. (угл. газа) = 100% – 97% = 3%. Ответ.  (угл. газа) = 97%, (угл. газа) = 97%,  (азота) = 3%. (азота) = 3%.
|
Задача 4. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
| Дано: | Решение:
1. Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. По уравнению реакции: | 0,25 | | 0,25 | | Fe + | 2HCl = FeCl2 + | H2 | | 1 моль | | 1 моль | Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 • 56 = 14 г. Теперь можно рассчитать массовые доли металлов в смеси:
ωFe = mFe/mвсей смеси = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
|
Примерные задачи:
1. Объемная доля метана в природном газе составляет 92%. Какой объем этой газовой смеси будет содержать 4,6 мл метана?
2. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
3. Найдите массу воды и лимонной кислоты, необходимую для приготовления 50 г 5%-го раствора.
4. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе.
5. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю вещества в полученном растворе.
6. Смешали 60 г 30 %-го раствора и 170 г 45 %-го раствора. Определите массовую долю растворенного вещества в новом растворе.
7. Какую массу 25 %-го раствора необходимо добавить к 220 г 40 %-го раствора, чтобы массовая доля растворенного вещества стала равной 30 %?
8. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
9. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
10. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
Справочные данные.
Условные обозначения, названия и единицы физических величин
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | P | Па, кПа |
| Количество вещества | n | моль |
| Масса вещества | M | г, кг |
| Массовая доля | w | безмерная |
| Молярная масса | M | г/ моль, кг/ кмоль |
| Молярный объём | Vm | л/ моль |
| Объём вещества | V | л, м3 |
| Объёмная доля | 
| безмерная |
| Относительная атомная масса | Ar | безмерная |
| Относительная молекулярная масса | Mr | безмерная |
| Относительная плотность газа А по газу В | DB(A) | безмерная |
| Плотность вещества | p | г/ мл, |
| Постоянная Авогадро | NA | 1/ моль |
| Температура абсолютная | T | К (кельвин) |
| Температура по шкале Цельсия | t | С0 (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/ моль |
Физические формулы, используемые для решения расчётных задач
NA = 6,02 • 1023 N = NA • n
|
Vm = 22,4 л / моль=22,4 м3/кмоль
|
M = Mr m = M . n
|
W(вещ-ва) = m(вещ-ва)/ m(р-ра) |
m =  • V V = m /
• V V = m / 
V1
P = m/V  = V2
= V2
Литература
1. Габриелян О.С. Программа курса химии для 10-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 10-11 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 10-11 класс. ВАКО, Москва, 2004г.
26