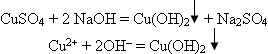-
Состав и классификация многоатомных спиртов. Оказывается, существуют ещё и другие спирты – многоатомные. Да, действительно, есть спирты, которые имеют две, три, шесть гидроксогрупп.
Формулы многоатомных спиртов, как и одноатомных, можно вывести из формул соответствующих углеводородов, заменяя в них атомы водорода гидроксильными группами.
Если, например, в формуле молекулы этана гидроксильными группами заместить два атома водорода (у каждого атома углерода по одному), то получится формула молекулы двухатомного спирта: СН2ОН – СН2ОН этиленгликоль, по систематической номенклатуре этандиол – 1,2. 2. Изомерия и номенклатура двух– и трёхатомных спиртов. В названиях многоатомных спиртов сначала называют углеводород, который лежит в основе спирта, затем, перед суффиксом – ОЛ ставят префикс, указывающий количество гидроксогрупп.( ди-, три, тетра-, пента, гекса- и т.д.), а в конце указывают номера атомов углерода при которых находятся гидроксогруппы. Задание: из формулы молекулы пропана вывести формулу молекулы трехатомного спирта глицерина и дать название по систематической номенклатуре Изомерия трёхатомных спиртов и двухатомных (гликолей) зависит от строения цепи и положения в ней гидроксильных групп. Напишите формулы спиртов: 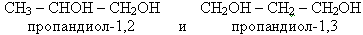
-
Физические свойства Ребята, перед вами пробирка с глицерином. Рассмотрите, что представляет собой это вещество. Опишите его физические свойства. Лабораторный опыт: растворимость глицерина в воде. К одному мл воды в пробирке прилейте равный объем глицерина и взболтайте смесь. Затем добавьте еще столько же глицерина. Что можно сказать о растворимости его в воде? Опишите свойства, которые вы наблюдаете. Ученики записывают в тетрадях планируемый ответ. Глицерин – бесцветная, сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде. Добавлю, что эти физические свойства присущи и другим многоатомным спиртам, в том числе и этиленгликолю. Надо помнить! Этиленгликоль очень ядовитое вещество! Задание: сравните физические свойства многоатомных и одноатомных спиртов Слайд 10 | Спирты | Относительная молекулярная масса | Температура кипения | Плотность г/см3 | | Этиловый | 46 | 78 | 0,79 | | Этиленгликоль | 62 | 197 | 1,11 | | Н-пропиловый | 60 | 97 | 0,80 | | Глицерин | 92 | 290 | 1,26 |
Подумайте о причине различия физических свойств одноатомных и многоатомных спиртов? Каковы изменения в относительных молекулярных массах спиртов? Каковы причины резкого различия температуры кипения? Сделайте вывод о влиянии числа гидроксильных групп на физические свойства. -
Химические свойства. Какие химические свойства характерные для одноатомных спиртов? Проблемный вопрос. А будут ли эти свойства характерны для многоатомных спиртов?
Чтобы ответить на это вопрос проведем демонстрационный эксперимент.
Взаимодействие глицерина с натрием: 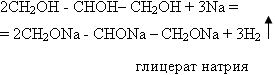
Взаимодействие глицерина с галогеноводородными кислотами: в пробирку налили соляной кислоты и добавили метиловый оранжевый. Далее прилили раствор глицерина до изменения окраски (происходит замещение гидроксогрупп). 
Сделайте вывод: как вещества, содержащие гидроксогруппы, многоатомные спирты имеют сходные свойства с одноатомными спиртами. Проблемный вопрос. Должно ли вызвать появление новых химических свойств увеличение числа гидроксогрупп в молекулах многоатомных спиртов?
Чтобы разрешить эту проблему проведем лаборатор 1. К двум мл раствора щелочи в пробирке прибавьте несколько капель раствора сульфата меди (II). Что наблюдаете? Напишите уравнение реакции. Ученик записывает уравнение на доске, а учащиеся в тетрадях. 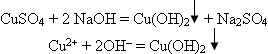
Наблюдали образование синего осадка гидроксида меди (II). 2. К образовавшемуся осадку гидроксида меди (II) прилейте глицерин и смесь встряхните. Какие изменения произошли? Учитель. Это качественная реакция на многоатомные спирты. Уравнение: Слайд 15 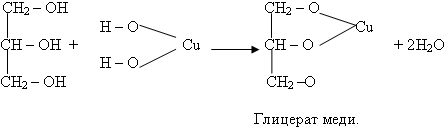
Уравнение дано в упрощенном виде, одновременно образуются и соединения более сложного состава. 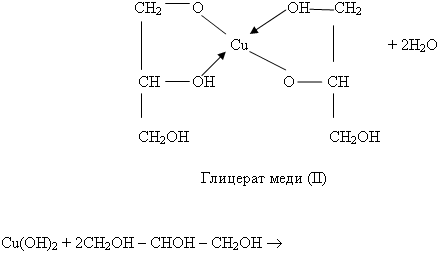
Лабораторный опыт 3. (индивидуально) Изучение физиологического действия этанола, глицерина на белок куриного яйца Задание: Провести лабораторный опыт «Изучение физиологического действия этанола, глицерина на белок куриного яйца». Для этого в пробирку с 1 мл. куриного белка добавьте этанол, а в другую пробирку с 1 мл куриного белка добавьте этанол. Зафиксировать результаты опыта и продемонстрировать всем обучающимся. К каким выводам вы пришли, проделав соответствующие опыты? Чем вы их объясните? Окисление многоатомных спиртов в упрощенном виде: С3Н8О3 + 3,5О2 =3 СО2 + 4 Н2О 14КМnО4 + 3С3Н5(ОН)3 = 7K2CO3 + 14MnO2 + 12H2O + 2CO2 Вывод: особенностью многоатомных спиртов является большая подвижность атомов водорода в гидроксогруппе и легкая окислительность радикала.
Причина: влияние этих групп друг на друга и на углеводородный радикал. Ребята, на примере многоатомных спиртов мы убеждаемся в том, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного влияния появление у спиртов новых свойств по сравнению с одноатомными. Получение многоатомных спиртов. 1. Подобно одноатомным спиртам, многоатомные спирты могут быть получены из соответствующих углеводородов через галогенопроизводные: (щелочной гидролиз) 
2. При пропускании этилена через раствор перманганата калия: 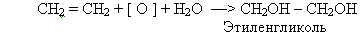
Учащиеся могут написать уравнения самостоятельно, т.к. знакомы с ними. 3. Гидратация оксида этилена: 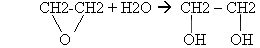
Глицерин получают: -
гидролизом жиров -
синтетическим способом из пропена |
Изменения в относительной массе одноатомных и многоатомных спиртов незначительные. Резкие изменения температуры кипения спиртов объясняются увеличением числа гидроксогрупп, следовательно, из- за увеличения числа водородных связей.
Следует вывод: число гидроксогрупп в спирте оказывает влияние на их физические свойства (за счет увеличения числа водородных связей). Учащиеся перечисляют свойства: реакция горения, реакция замещения водорода гидроксогруппы на щелочной металл, реакция обмена всей гидроксогруппы на галоген (с галогеноводородами и другие).
Вывод: как вещества, содержащие гидроксогруппы, многоатомные спирты имеют сходные свойства с одноатомными спиртами
Лабораторный опыт: 1. К двум мл раствора щелочи в пробирке прибавьте несколько капель раствора сульфата меди (II). Что наблюдаете? Напишите уравнение реакции. Ученик записывает уравнение на доске, а учащиеся в тетрадях. 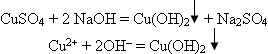
Наблюдали образование синего осадка гидроксида меди (II). 2. К образовавшемуся осадку гидроксида меди (II) прилейте глицерин и смесь встряхните. Какие изменения произошли? Осадок растворяется и образуется раствор ярко-синего цвета, глицерат меди (II).
|