

- Оксиды – бинарные соединения, в состав которых входит кислород.
- Оксиды металлов – твердые вещества.
- Гидроксиды – сложные вещества, соответствующие оксидам, если к ним присоединены одна или несколько гидроксидных групп.

- 1.Металл + кислород = оксид или пероксид.
- 2.Металл + вода = водород + щелочь (если основание растворимо в воде)
или = водород + основание (если основание не растворимо в воде)
Реакция протекает только в том случае, если
металл находится в ряду активности до водорода.
Основание – сложное вещество, в котором каждый атом металла связан с одной или несколькими гидроксогруппами.

- Оксиды и гидроксиды металлов
в степенях окисления +1 и +2 проявляют основные свойства ,
- в степенях окисления +3, +4, +5 проявляют амфотерные ,
- в степенях окисления +6, +7 проявляют кислотные .


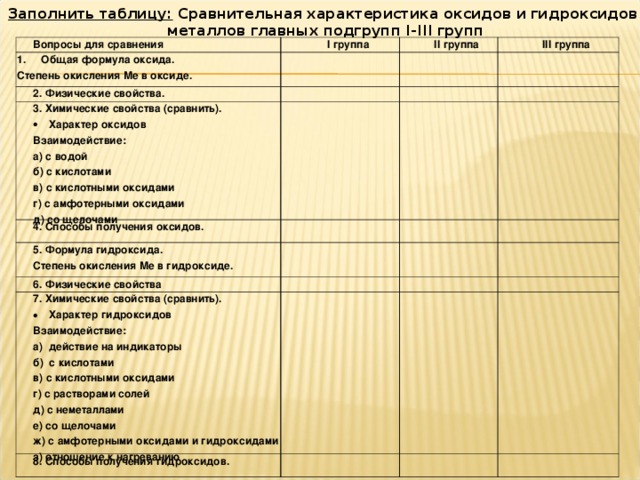
Заполнить таблицу: Сравнительная характеристика оксидов и гидроксидов
металлов главных подгрупп I - III групп
Вопросы для сравнения
I группа
II группа
Степень окисления Ме в оксиде.
2. Физические свойства.
III группа
3. Химические свойства (сравнить).
4. Способы получения оксидов.
Взаимодействие:
а) с водой
б) с кислотами
в) с кислотными оксидами
г) с амфотерными оксидами
д) со щелочами
5. Формула гидроксида.
Степень окисления Ме в гидроксиде.
6. Физические свойства
7. Химические свойства (сравнить).
8. Способы получения гидроксидов.
Взаимодействие:
а) действие на индикаторы
б) с кислотами
в) с кислотными оксидами
г) с растворами солей
д) с неметаллами
е) со щелочами
ж) с амфотерными оксидами и гидроксидами
з) отношение к нагреванию

Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
Na 2 O , Mg +2 O , Al 2 O 3
основные амфотерный
Na +1 O Н , Mg +2 (O Н ) 2 , Al +3 (O Н ) 3
щелочь Слабое Амфотерный
основание гидроксид
В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз .

Соединения металлов I А группы
Оксиды щелочных металлов
Общая формула Ме 2 О
Физические свойства: Твердые, кристаллические вещества, хорошо растворимые в воде.
Li 2 O , Na 2 O – бесцветные, К 2 О, Rb 2 O – желтые, Cs 2 О – оранжевый.
Способы получения:
Окислением металла получается только оксид лития
4 Li + O 2 → 2 Li 2 O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li 2 O ) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na 2 O 2 + 2Na → 2Na 2 O
KO 2 + 3K → 2K 2 O
Химические свойства
Типичные основные оксиды:
Взаимодействуют с водой, образуя щелочи: Na 2 О + H 2 O →
2. Взаимодействуют с кислотами, образуя соль и воду: Na 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами, образуя соли: Na 2 О + ZnO → Na 2 ZnO 2

Гидроксиды щелочных металлов
Общая формула – МеОН
Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Сильные основания - Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
Способы получения:
1. Электролиз растворов хлоридов:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2
2. Обменные реакции между солью и основанием:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2 Li + 2 H 2 O → 2 LiOH + H 2
Li 2 O + H 2 O → 2 LiOH
Na 2 O 2 + 2 H 2 O → 2 NaOH + H 2 O 2
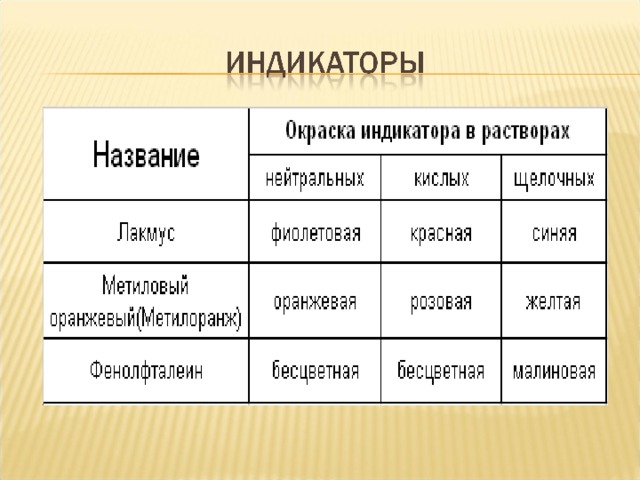
![Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H 2 O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO 3 → Na 2 SO 4 + H 2 O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ] 2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ] 7. При нагревании не разлагаются, кроме LiOH .](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img11.jpg)
Химические свойства
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H 2 O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ]
2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ]
7. При нагревании не разлагаются, кроме LiOH .
![Соединения металлов главной подгруппы II группы Оксиды металлов II А группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba , который образует пероксид) 2Са + О 2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO 3 → CaO + CO 2 2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2 Химические свойства ВеО – амфотерный оксид Оксиды Mg , Ca , Sr , Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание): СаО + H 2 O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img12.jpg)
Соединения металлов главной подгруппы II группы
Оксиды металлов II А группы
Общая формула МеО
Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде.
Способы получения:
Окисление металлов (кроме Ba , который образует пероксид)
2Са + О 2 → 2СаО
2) Термическое разложение нитратов или карбонатов
CaCO 3 → CaO + CO 2
2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2
Химические свойства
ВеО – амфотерный оксид
Оксиды Mg , Ca , Sr , Ba – основные оксиды
Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание):
СаО + H 2 O →
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]

Гидроксиды металлов II А группы
Общая формула – Ме(ОН) 2
Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2
Способы получения:
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2 H 2 O → Ba ( OH ) 2 + H 2
CaO (негашеная известь) + H 2 O → Ca ( OH ) 2 (гашеная известь)
![Химические свойства Ве(ОН) 2 – амфотерный гидроксид Mg (ОН) 2 – слабое основание Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН) 2 + Н 2 SO 4 → 3. Взаимодействуют с кислотными оксидами: Са(ОН) 2 + SO 3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок: Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ] При нагревании разлагаются: Са(ОН) 2 →](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img14.jpg)
Химические свойства
Ве(ОН) 2 – амфотерный гидроксид
Mg (ОН) 2 – слабое основание
Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.
Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3. Взаимодействуют с кислотными оксидами:
Са(ОН) 2 + SO 3 →
4. Взаимодействуют с растворами солей, если образуется газ или осадок:
Ва(ОН) 2 + K 2 SO 4 →
Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ]
При нагревании разлагаются: Са(ОН) 2 →

Соединения металлов главной подгруппы III группы
Соединения алюминия
Оксид алюминия
Al 2 O 3
O = Al – O – Al = O
Физические свойства: Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий).
Твердое тугоплавкое ( t° пл.=2050 ° С) вещество; существует в нескольких кристаллических модификациях.
Способы получения:
Сжигание порошка алюминия: 4 Al + 3 O 2 → 2 Al 2 O 3
Разложение гидроксида алюминия: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O
![Химические свойства Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует. 1) Реагирует с кислотами и растворами щелочей: Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ] 2) Сплавляется со щелочами или карбонатами щелочных металлов: Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2 Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img16.jpg)
Химические свойства
Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1) Реагирует с кислотами и растворами щелочей:
Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O
![Гидроксид алюминия Al ( OH ) 3 Физические свойства: белое кристаллическое вещество, нерастворимое в воде. Способы получения: 1) Осаждением из растворов солей щелочами или гидроксидом аммония: AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый) 2) Слабым подкислением растворов алюминатов: Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3 Химические свойства Al ( OH ) 3 - а мфотерный гидроксид : 1) Реагирует с кислотами и растворами щелочей: Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ] (тетрагидроксоалюминат натрия) При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img17.jpg)
Гидроксид алюминия Al ( OH ) 3
Физические свойства: белое кристаллическое вещество,
нерастворимое в воде.
Способы получения:
1) Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4
Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый)
2) Слабым подкислением растворов алюминатов:
Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3
Химические свойства
Al ( OH ) 3 - а мфотерный гидроксид :
1) Реагирует с кислотами и растворами щелочей:
Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O
Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ]
(тетрагидроксоалюминат натрия)
При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O

Заполнить таблицу: Сравнительная характеристика оксидов и гидроксидов
металлов главных подгрупп I - III групп
Вопросы для сравнения
I группа
II группа
Степень окисления Ме в оксиде.
2. Физические свойства.
III группа
3. Химические свойства (сравнить).
4. Способы получения оксидов.
Взаимодействие:
а) с водой
б) с кислотами
в) с кислотными оксидами
г) с амфотерными оксидами
д) со щелочами
5. Формула гидроксида.
Степень окисления Ме в гидроксиде.
6. Физические свойства
7. Химические свойства (сравнить).
8. Способы получения гидроксидов.
Взаимодействие:
а) действие на индикаторы
б) с кислотами
в) с кислотными оксидами
г) с растворами солей
д) с неметаллами
е) со щелочами
ж) с амфотерными оксидами и гидроксидами
з) отношение к нагреванию
















![Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H 2 O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO 3 → Na 2 SO 4 + H 2 O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ] 2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ] 7. При нагревании не разлагаются, кроме LiOH .](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img11.jpg)
![Соединения металлов главной подгруппы II группы Оксиды металлов II А группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba , который образует пероксид) 2Са + О 2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO 3 → CaO + CO 2 2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2 Химические свойства ВеО – амфотерный оксид Оксиды Mg , Ca , Sr , Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание): СаО + H 2 O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img12.jpg)

![Химические свойства Ве(ОН) 2 – амфотерный гидроксид Mg (ОН) 2 – слабое основание Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН) 2 + Н 2 SO 4 → 3. Взаимодействуют с кислотными оксидами: Са(ОН) 2 + SO 3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок: Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ] При нагревании разлагаются: Са(ОН) 2 →](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img14.jpg)

![Химические свойства Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует. 1) Реагирует с кислотами и растворами щелочей: Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ] 2) Сплавляется со щелочами или карбонатами щелочных металлов: Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2 Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img16.jpg)
![Гидроксид алюминия Al ( OH ) 3 Физические свойства: белое кристаллическое вещество, нерастворимое в воде. Способы получения: 1) Осаждением из растворов солей щелочами или гидроксидом аммония: AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый) 2) Слабым подкислением растворов алюминатов: Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3 Химические свойства Al ( OH ) 3 - а мфотерный гидроксид : 1) Реагирует с кислотами и растворами щелочей: Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ] (тетрагидроксоалюминат натрия) При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img17.jpg)











