ГЛАВНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ
ГОМЕЛЬСКОГО ОБЛАСТНОГО ИСПОЛНИТЕЛЬНОГО КОМИТЕТА

МОЗЫРСКИЙ ГОСУДАРСТВЕННЫЙ
ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
открытого занятия по дисциплине
«Физическая и коллоидная химия»
«Осмотическое давление
в растворах электролитов и неэлектролитов.
Изотонический коэффициент»
Специальность 2-48 01 35 «Переработка нефти и газа»
| Автор: преподаватель химии высшей квалификационной категории учреждения образования «Мозырский государственный политехнический колледж» Саяпина Наталья Владимировна |
ПЛАН ЗАНЯТИЯ
Тема занятия: Осмотическое давление в растворах электролитов и неэлектролитов. Изотонический коэффициент
Обучающая цель: раскрыть сущность осмоса, осмотического давления; рассмотреть значения осмоса и осмотического давления; научиться решать задачи на вычисление осмотического давления, изотонического коэффициента и степени диссоциации электролита.
Воспитательная цель: продолжить формирование положительного отношения к знаниям.
Развивающая цель: развивать у учащихся умение рассуждать и делать выводы; развивать логическое мышление путем сравнения, обобщения, анализа.
Методическая цель: использование межпредметных связей для дополнения, подтверждения или восполнения знаний учащихся по предметам естественно-математического цикла.
Междисциплинарные связи: физика, биология, математика
Тип занятия: занятие формирования новых знаний
Оснащение урока: компьютер, экран, проектор, интерактивная доска, презентация, задание «Способы выражения концентрации растворов», пробирки, штатив, держатель, раствор перманганата калия, вода, карточки
ХОД ЗАНЯТИЯ
I ОРГАНИЗАЦИОННЫЙ МОМЕНТ – проверка присутствующих, вопросы о готовности группы, постановка целей
II АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ
Сегодня на занятии мы с вами расширяем и углубляем знания по теме «Растворы».
А) Фронтальный опрос.
Что такое раствор?
Какие способы классификации растворов вы знаете?
Что является основной характеристикой растворов?
Какие способы выражения концентрации вам известны? Какие расчетные формулы вы знаете?
Чтобы ответить на этот вопрос перейдите по ссылке зашифрованной QR-кодом (приложение 1).

III ИЗЛОЖЕНИЕ НОВОГО МАТЕРИАЛА
План:
1. Диффузия, её физический смысл, примеры диффузии.
2. Осмос. Осмотическое давление. Изотонический коэффициент, его физический смысл.
3. Закон Вант-Гоффа для растворов неэлектролитов и электролитов.
Объяснение явления
Если поместить в стакан концентрированный раствор сахара, а сверху налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно. Однако через некоторое время молекулы сахара и воды вновь равномерно распределятся по всему объему жидкости.
Результатом, какого явления это является? Почему это происходит?
Это результат диффузии. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный раствор, так и в обратном направлении. Но при этом, в течение любого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, но при этом больше молекул воды переходит из более разбавленного раствора.
Демонстрация опыта. Диффузия в жидкости
Диффузию можно наблюдать, если налить в стеклянный цилиндр какой-либо окрашенный раствор, например, KMnO4, а сверху него осторожно, чтобы не вызвать перемешивания, добавить воды. Вначале заметна резкая граница, но постепенно она размывается; через некоторое время, растворенное вещество равномерно распределяется по всему объему раствора, и вся жидкость принимает один цвет.
Результатом, какого явления это является? Почему то происходит?
В рассмотренном примере частицы растворителя и растворенного вещества диффундируют в противоположных направлениях. Такой случай называется встречной или двусторонней диффузией.
Демонстрация опыта. Диффузия в газах
Можно воспользоваться дезодорантом, то можно ощутить изменения, произошедшие в аудитории. Появляется запах, который почувствовали сначала те, кто сидит близко к столу, а затем и сидящие на отдаленных местах. Концентрация пахучего вещества в воздухе выравнивается.
Результатом, какого явления это является? Почему это происходит?
Это происходит потому, что молекулы вещества всегда движутся преимущественно в том направлении, где концентрация вещества меньше. Такой процесс ведет к выравниванию концентраций.
Вывод: Диффузией называется самопроизвольное проникновение и перемешивание частиц соприкасающихся газов, жидкостей и твердых тел, результатом которых является выравнивание концентраций, обусловленное переносом вещества за счет молекулярного движения.
Представим себе сосуд, в котором есть перегородка, например, из стекла. В разные половинки сосуда налиты растворы разной концентрации (вода и раствор сахара).
Будет ли происходить диффузия в этом случае?
Нет, потому что перегородка непроницаема ни для молекул воды, ни для молекул сахара.
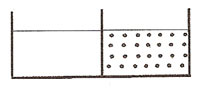
Рис. 1
Иначе будет обстоять дело, если между двумя растворами поместить перегородку, через которую растворитель может проходить, а растворенное вещество - не может. Такие перегородки, получившие название полупроницаемых, существуют в природе, а также могут быть получены искусственно.
Что же будет происходить, если между двумя растворами поместить полупроницаемую перегородку (мембрану)?
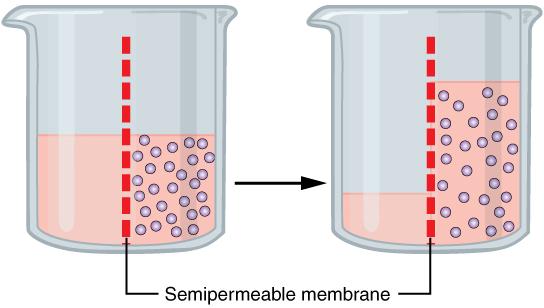
Молекулы растворителя будут перемещаться в обе стороны, но больше молекул будет переходить от растворителя к раствору. Молекулы растворенного вещества перемещаться не будут. Это частный случай диффузии. Явление, которое называется осмос.
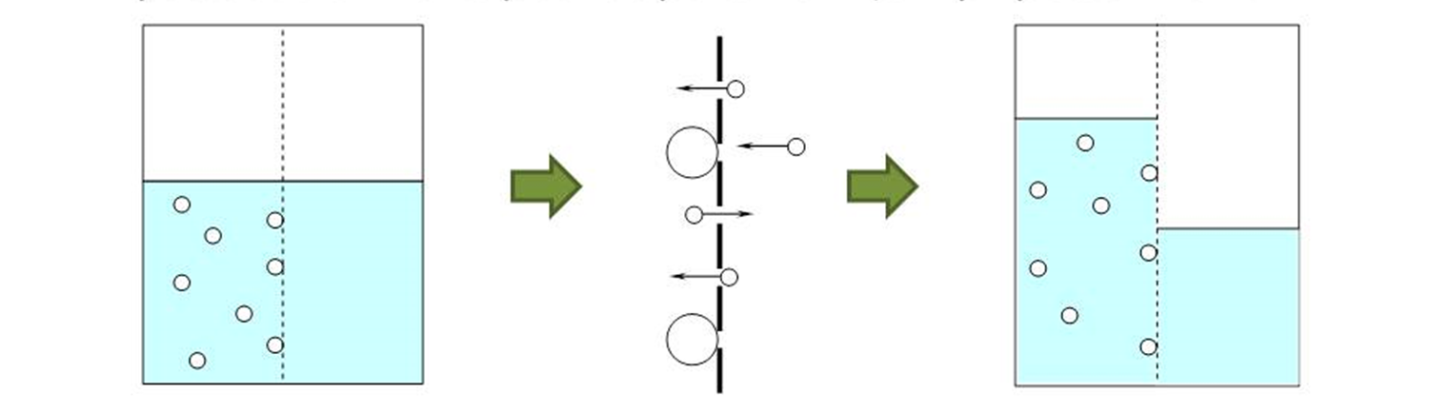
Осмос - это диффузия растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Мембраны могут разделять раствор и чистый растворитель, а также растворы разной концентрации.
Когда уровень жидкости в трубке достигнет определенной высоты, дальнейшее проникновение воды в сосуд прекратится, так как этому будет препятствовать гидростатическое давление столба жидкости в трубке.
Давление, которое создает растворитель в результате осмоса, называется осмотическим давлением.
Или давление, которое нужно приложить к системе для того чтобы остановить односторонний переход растворителя называется осмотическим давлением.
Если же приложенное внешнее давление превысит осмотическое, то диффузия воды будет преимущественно происходить из раствора в водную фазу, т.е. в направлении, противоположном направлению переноса воды при осмосе. Такое явление получило название обратного осмоса.
В настоящее время обратный осмос широко применяют как один из наиболее экономичных способов опреснения воды.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных во внутриклеточной жидкости. Проникая в клетки, вода создает в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью, тургором.
Если срезать растение, то вследствие испарения воды объем внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми - растение вянет. Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
При измерении осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя.
В 1886 г. Вант-Гофф показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается уравнением (закон Вант-Гоффа):
Р = СRТ
Р - осмотическое давление раствора, кПа;
С - молярная концентрация, моль/л;
R- универсальная газовая постоянная, 8,314Дж/(моль*К);
Т - абсолютная температура раствора.
IV ЗАКРЕПЛЕНИЕ
1. Установите соответствие
Какое явление лежит в основе всасывания волосками корней растений питательных веществ из почвы?
Количественное выражение содержания растворенного вещества в растворе.
Подберите синоним к перечисленным понятиям - перепонка, диафрагма, клеточная стенка …
Как называется давление, создаваемое неорганическими солями в плазме крови?
Как называется напряженное состояние растительных тканей, создаваемое осмотическим давлением?
От какой физической величины не зависит осмотическое давление?
За счет чего дым от костра по мере подъема перестает быть видимым?
А/ диффузия
Б/ полупроницаемая мембрана
В/ осмос
Г/ осмотическое давление
Д/ концентрация
Ж/ универсальная газовая постоянная
З/ тургор
Ключ:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| В | Д | Б | Г | З | Ж | А |
2.Решение расчетных задач
Задание 1.
Определите осмотическое давление в 0,01 М растворе неэлектролита при 25 оС.
Решение.
Росм = CRT = 0,01*8,31*(273+25) = 24,764 кПа.
Ответ: 24,764 кПа
Задание 2.
Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы C6H12O6 при 0 °С.
Решение:
Молярная масса глюкозы составляет 180 г/моль, следовательно, в 1,4 л раствора содержится количество вещества глюкозы
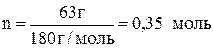 .
.
Осмотическое давление этого раствора глюкозы равно
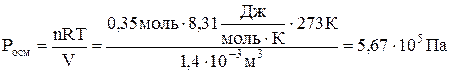 .
.
Дж = Па ∙ м3; 1л = 10 –3 м3.
Задание 3.
Рассчитать молярную массу неэлектролита, если в 5 л раствора содержится 2,5 г растворенного вещества. Осмотическое давление этого раствора при 20 °С равно 0,23×105 Па.
Решение:
Молярную массу неэлектролита находим по формуле
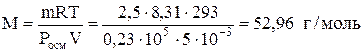 .
.
Ответ: 52,96 г/моль
Задание 3.
Определить осмотическое давление в 0,1% растворе хлорида натрия при температуре 25 оС, считая его диссоциацию полной. Плотность принять равной 1.
Решение.
Для электролитов необходимо учитывать изотонический коэффициент.
При полной диссоциации степень диссоциации α = 1.
Уравнение диссоциации: NaCl = Na+ + Cl-. Cоль распадается на 2 иона, k = 2.
i = 1 + α(k - 1) = 1 + 1(2 - 1) = 2.
Определим молярную концентрацию раствора.
См = 10wp/Mr = 10*0,1*1/58,5 = 0,017 моль/л.
Росм = iCRT = 2*0,017*8,31*298 = 84,2 кПа.
Ответ: 84,2 кПа
Задание 4.
Определить молярную массу неэлектролита, если литр раствора, содержащий 1,8 г растворенного вещества, создает при 25 оС осмотическое давление, равное 24,764 кПа.
Решение.
Определим молярную концентрацию.
См = Росм/RT = 24,764/8,31*298 = 0,01 моль/л.
Это количество вещества соответствует массе 1,8 г. Отсюда,
M = m/n = 1,8/0,01 = 180 г/моль.
Ответ: 180 г/моль
Задание 5.
Определить степень диссоциации бромида алюминия, если литр раствора, содержащий 26,7 г. растворенного вещества, создает при 0 оС осмотическое давление, равное 635,22 кПа.
Решение.
Определим молярность раствора.
См = m/Mr*V = 26,7/267*1 = 0,1 моль/л.
Определим изотонический коэффициент.
i = Росм/CRT = 635,22/0,1*8,31*273 = 2,8.
Определим степень диссоциации.
i = 1 + α(k - 1), для бромида алюминия k = 4. Отсюда,
α = (i - 1)/(k - 1) = (2,8 - 1)/(4 - 1) = 0,6 или 60%.
Ответ: 0,6 или 60%.
Задание 6
При определенной температуре 0,2 М раствор хлорида кальция изотоничен 0,5 М раствору глюкозы. Определите степень диссоциации соли.
Решение.
Изотоническими называют растворы с равным осмотическим давлением.
Pосм(CaCl2) = iC1RT,
Pосм(C6H12O6) = C2RT.
По условию, Pосм(CaCl2) = Pосм(C6H12O6)
Отсюда, iC1RT = C2RT.
i = C2RT/C1RT = C2/C1 = 0,5/0,2 = 2,5. Для CaCl2, k = 3.
α = (i - 1)/(k - 1) = (2,5 - 1)/(3 - 1) = 0,75 или 75%.
Ответ: 0,75 или 75%.
V ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ
Комментирование и выставление отметок
VI ВЫДАЧА ДОМАШНЕГО ЗАДАНИЯ
[1], § 5.4, 5.7, 5.8(п.5,6) стр. 141 в.12,13
Осмотическое давление в растворах
Приложение 1
Задание по теме «Состав растворов»

Приложение 2
Объясните явление

ПРИЛОЖЕНИЕ 3
Осмос. Осмотическое давление

ПРИЛОЖЕНИЕ 4
Установите соответствие:
| 1. Какое явление лежит в основе всасывания волосками корней растений питательных веществ из почвы? 2. Количественное выражение растворенного вещества в растворе. 3. Подберите синоним к перечисленным понятиям - перепонка, диафрагма, клеточная стенка … 4. Как называется давление, создаваемое неорганическими солями в плазме крови? 5. Как называется напряженное состояние растительных тканей, создаваемое осмотическим давлением? 6. От какой физической величины не зависит осмотическое давление? 7. За счет чего дым от костра по мере подъема перестает быть видимым?
| А/ диффузия Б/ полупроницаемая мембрана В/ осмос Г/ осмотическое давление Д/ концентрация Ж/ универсальная газовая постоянная З/ тургор
|
ПРИЛОЖЕНИЕ 5.
Решение задач
| № | Неэлектролит | Содержание | Объем раствора | Температура | Формула |
| 1 | – | 0,2 моль | 1л | 25 0С, 100 0С | - |
| 2 | – | 0,15 моль | 2л | 25 0С, 80 0С | - |
| 3 | – | 0,02 моль | 3 л | 25 0С, 50 0С | - |
| 4 | – | 0,04 моль | 4 л | 25 0С, 100 0С | - |
| 5 | сахар | 91 г | 1л | 25 0С, 80 0С | C12H22O11 |
| 6 | глицерин | 46г | 3л | 25 0С, 50 0С | С3H5(OH)3 |
| 7 | сахар | 68,4г | 3л | 25 0С, 100 0С | C12H22O11 |
| 8 | анилин | 3,72г | 1л | 25 0С, 80 0С | C6H5NH2 |
| 9 | глицерин | 0,736г | 0,4л | 25 0С, 50 0С | С3H5(OH)3 |
| 10 | глюкоза | 90,08г | 4л | 25 0С, 100 0С | C6H12O6 |












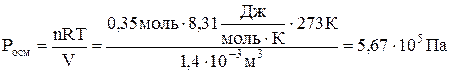 .
.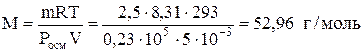 .
.










