
СВОЙСТВА ЖЕЛЕЗА

«…касательно нашей молодёжи, не стоит забывать, что Узбекистан – мульти-язычная страна мирового уровня и специалисты, которыми вскоре станут представители подрастающего поколения не должны уступать остальным странам в плане образованности и профессионализма в различных сферах деятельности.»
И.А. Каримов.

I вариант
Проблема:
Тесты:
1) Определите электронную формулу иона Fe .
Почему кровь имеет красный цвет и является основным транспортом для полезных веществ ?
а) 1s, 2s, 2p, 3s, 3p, 3d .
б) 1s, 2s, 2p, 3s, 3p, 3d, 4s .
в) 1s, 2s, 2p, 3s, 3p, 4s, 3d .
2) Сколько г. Fe восстановится из оксида Fe (II) массой 29 г. ?
а) 20 г. б) 22,56 г. в) 20,3 г.
3+
2 2 6 2 6 5
2 2 6 2 6 6 2
2 2 6 2 6 2 7
Понятие:
Составьте уравнение реакций получение Fe восстановлением его из оксидов.
Коррозия это -

II вариант
Тесты:
Проблема:
1) Определите степень окисления Fe и его массовую долю (в %) в соли FeCl 3 .
Зачем железо покрывают цинком?
а) +2 ; 27% б) +3 ; +39% в) +3 ; 34,45%
2) Определите электронную формулу иона Fe .
а) 1s, 2s, 2p, 3s, 3p, 3d, 4s .
б) 1s, 2s, 2p, 3s, 3p, 3d .
в) 1s, 2s, 2p, 3s, 3p, 4s, 3d .
2+
2 2 6 2 6 6 2
2 2 6 2 6 6
2 2 6 2 6 2 7
Понятие:
Составьте уравнение реакции получения железа способом алюмотермии.
Алюмотермия это -

I вариант
Проблема:
Тесты:
Почему кровь имеет красный цвет и является основным транспортом для полезных веществ ?
1)Определите электронную формулу иона Fe .
а) 1s, 2s, 2p, 3s, 3p, 3d .
б) 1s, 2s, 2p, 3s, 3p, 3d, 4s .
в) 1s, 2s, 2p, 3s, 3p, 4s, 3d .
2) Сколько г. Fe восстановится из оксида Fe (II) массой 29 г. ?
а) 20 г. б) 22,56 г. в) 20,3 г.
3+
2 2 6 2 6 5
Эритроциты – красные кровяные тельца, которые переносят гемоглабин
ко всем органам. Гемоглабин содержит Fe, которое доставляется эритроцитом в лёгкие, где оно насыщается O 2 и в следствии этого получает красный цвет. Так как O 2 переноситься лишь насыщенными эритроцитами, которые содержатся только в крови, кровь является главным транспортным средством.
2 2 6 2 6 6 2
2 2 6 2 6 2 7
Понятие:
Составьте уравнение реакций получение Fe восстановлением его из оксидов.
Коррозия это -
самопроизвольное разрушение металлов
в результате химического взаимодействия со средой.
FeO+H 2 Fe+H 2 O
Fe 2 O 3 +3CO 2Fe+3CO 2

II вариант
Проблема:
Тесты:
1) Определите степень окисления Fe и его массовую долю (в %) в соли FeCl 3 .
Зачем железо покрывают цинком?
а) +2 ; 27% б) +3 ; +39% в) +3 ; 34,45%
2) Определите электронную формулу иона Fe .
а) 1s, 2s, 2p, 3s, 3p, 3d, 4s .
б) 1s, 2s, 2p, 3s, 3p, 3d .
в) 1s, 2s, 2p, 3s, 3p, 4s, 3d .
Если металлическое покрытие состоит из более активного металла, чем защищаемый металл, например, на поверхности Fe имеется покрытие из Zn, то Zn, образующий защитный слой, становится анодом и образуется анодное покрытие. Железо будет защищено пока не разрушится весь цинковый слой.
2+
2 2 6 2 6 6 2
2 2 6 2 6 6
2 2 6 2 6 2 7
Составьте уравнение реакции получения железа способом алюмотермии.
Понятие:
Алюмотермия это -
восстановление железа с помощью алюминия из его оксидов.
3Fe 3 O 4 +8Al 9Fe+4Al 2 O 3

I вариант Задача:
Вычислите объём оксида углерода (II) (н.у.), который потребуется для восстановления до металла 8 кг. оксида железа (III).

Дано: Решение:
m(Fe 2 O 3 )=8кг. Fe 2 O 3 +3CO 2Fe+3CO 2
V(CO) 3 -? n(Fe 2 O 3 ) : n(CO)
n(Fe 2 O 3 ) = = 50моль.
Значит n (CO) = 50 моль*3 =
150 моль
V = n * Vm
V(CO) = 150 моль*22,4 л/моль=
= 3360л. = 3,36м³
Ответ: V(CO) = 3,36м³.
8 кг. Х л.
160 г./моль 22,4 л./моль
1 : 3
8000г.
160г./моль

II вариант Задача:
Вычислите массу соли, которая получится при действии 98 г. 5%-ного раствора серной кислоты на избыток железа.

Дано: Решение:
m р-ра (H 2 SO 4 )= 98г. Fe+H 2 SO 4 FeSO 4 +H 2
ω(H 2 SO 4 )= 5%
m(FeSO 4 )= ? m в-ва =
m(H 2 SO 4 ) = = 4,9г.
n(H 2 SO 4 ) = n(FeSO 4 )
n(H 2 SO 4 ) = = 0,05 моль
Значит m(FeSO 4 ) = 0,05моль*152 г./моль. = 7,6 г.
Ответ: m(FeSO 4 ) = 7,6 г.
4,9 г. Х г.
98 г./моль 52 г./моль
ω*m р-ра 100%
5%*98г.
100%
4,9 г.
98г./моль
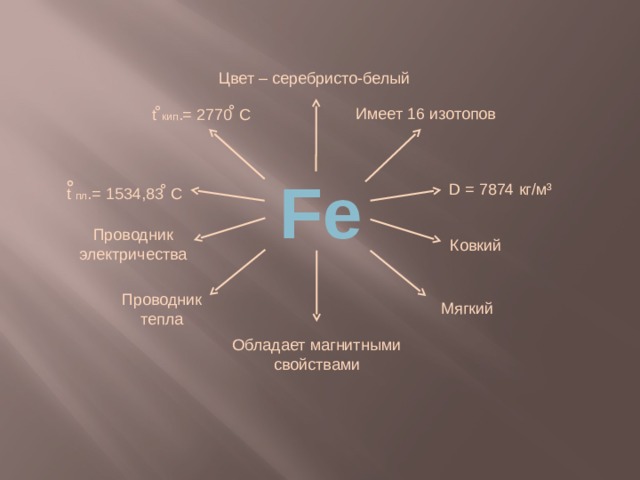
Цвет – серебристо-белый
t ̊ кип .= 2770 ̊ С
Имеет 16 изотопов
Fe
t ̊ пл .= 1534,83 ̊ С
D = 7874 кг/м³
Проводник
электричества
Ковкий
Проводник
тепла
Мягкий
Обладает магнитными
свойствами
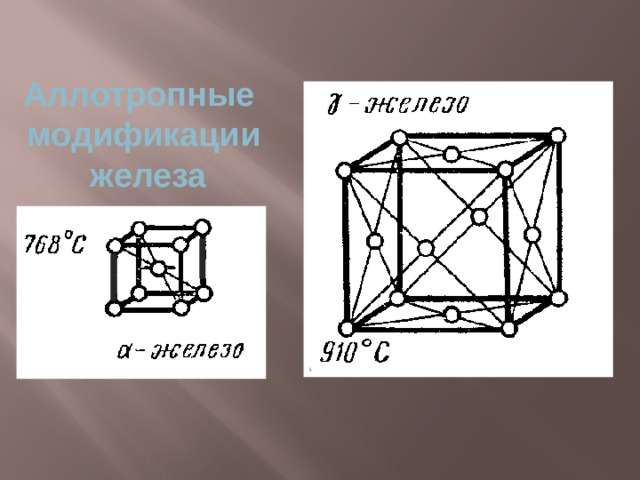
Аллотропные
модификации
железа


При нагревании железо взаимодействует с хлором:
2Fe+3Cl 2 2FeCl 3
(трихлорид железа (III))

При нагревании железо взаимодействует с серой:
Fe+S FeS
(сульфид железа)

При нагревании железо взаимодействует с углеродом:
3Fe+C Fe3C
(карбид железа)

При нагревании железо взаимодействует с азотом:
2Fe+N 2 2FeN
(Нитрид железа (III))

Раскалённое железо взаимодействуя с парами воды, образует железную окалину и водород:
3Fe+4H 2 O Fe 3 O 4 +4H 2
Реакция обратима.

В присутствии влаги и воздуха железо подвергается коррозии – ржавеет.

Ржавчина состоит из гидрооксида железа – вещества жёлто-бурого цвета:
Fe(OH) 3

I группа
Взаимодействует ли железо с кислотами и солями?
Подгруппа №1
Подгруппа №2
В пробирке №1 кусочек Fe.
В двух пробирках кусочки Fe.
В пробирке №3 HCl (разб.)
В пробирке №2 раствор CuSO 4.
В пробирке №4 H 2 SO 4 (разб.)
1) В пробирку №1 прилейте
CuSO 4 к Fe. Установите в нагреватель пробирок.
2) Пронаблюдайте.
раствор разбавленной
HCl. Установите в нагреватель пробирок.
3) Впишите в таблицу наблюдения и уравнения реакций.
2) В пробирку №2 прилейте раствор разбавленной H 2 SO 4 . Установите в нагреватель пробирок.
3) Пронаблюдайте какой газ выделился. Почему ?
4) Впишите в таблицу наблюдения и уравнения реакций.
![II группа Распознавание солей двухвалентного железа. Подгруппа №1 Подгруппа №2 В пробирке раствор FeSO 4 . В пробирке Раствор FeSO 4 . В капельнице раствор K 3 [Fe(CN) 6 ] В капельнице раствор NaOH. 1) Добавьте в пробирку с раствором FeSO 4 3-5 капель NaOH. (гексациано (III) феррат калия или красная кровяная соль). 1) Добавьте в пробирку с FeSO 4 . 3-5 капель K 3 [Fe(CN) 6 ]. 3) Пронаблюдайте. 2) Пронаблюдайте. 4) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 5) Впишите в таблицу наблюдения и уравнения реакций. 3) Составьте молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций в таблицу.](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img21.jpg)
II группа
Распознавание солей двухвалентного железа.
Подгруппа №1
Подгруппа №2
В пробирке раствор FeSO 4 .
В пробирке Раствор FeSO 4 .
В капельнице раствор K 3 [Fe(CN) 6 ]
В капельнице раствор NaOH.
1) Добавьте в пробирку с раствором FeSO 4 3-5 капель NaOH.
(гексациано (III) феррат калия или красная кровяная соль).
1) Добавьте в пробирку с FeSO 4 . 3-5 капель K 3 [Fe(CN) 6 ].
3) Пронаблюдайте.
2) Пронаблюдайте.
4) Запишите молекулярное, полное ионное и сокращённое ионное уравнение.
5) Впишите в таблицу наблюдения и уравнения реакций.
3) Составьте молекулярное, полное ионное и сокращённое ионное уравнение.
4) Впишите в таблицу наблюдения и уравнения реакций в таблицу.
![III группа Распознавание солей трёхвалентного железа. Подгруппа №1 Подгруппа №2 В пробирке раствор FeCl 3 . В пробирке раствор FeCl 3 . В капельнице K 4 [Fe(CN) 6 ] (гексациано (II) феррат калия или жёлтая кровяная соль). В капельнице раствор NaOH. 1) В пробирку FeCl 3 добавьте 3-5 капель NaOH. В Пробирку с FeCl 3 добавьте 3-5 капель K 4 [Fe(CN) 6 ]. 2) Пронаблюдайте. 2) Пронаблюдайте. 3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций. 3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций.](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img22.jpg)
III группа
Распознавание солей трёхвалентного железа.
Подгруппа №1
Подгруппа №2
В пробирке раствор FeCl 3 .
В пробирке раствор FeCl 3 .
В капельнице K 4 [Fe(CN) 6 ] (гексациано (II) феррат калия или жёлтая кровяная соль).
В капельнице раствор NaOH.
1) В пробирку FeCl 3 добавьте 3-5 капель NaOH.
- В Пробирку с FeCl 3 добавьте
3-5 капель K 4 [Fe(CN) 6 ].
2) Пронаблюдайте.
2) Пронаблюдайте.
3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение.
4) Впишите в таблицу наблюдения и уравнения реакций.
3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение.
4) Впишите в таблицу наблюдения и уравнения реакций.

I группа Вывод:
Подгруппа №1:
Fe+2HCl р FeCl 2 +H 2
Fe+H 2 SO 4 FeSO 4 +H 2
В ряду активности металлов Fe располагается слева от водорода, поэтому при взаимодействии с растворами разбавленных соляной и серной кислот, Fe вытесняет водород.
Подгруппа №2:
Fe+CuSO 4 FeSO 4 +Cu
Fe вытесняет из растворов солей металлы, стоящие за ним в ряду активности металлов.

Железо не взаимодействует с концентрированными азотной и серной кислотами.
Fe+H 2 SO 4
Fe+HNO 3

Для перевозки концентрированной H 2 SO 4 используют железные цистерны :

Но если железо будет нагрето, реакция c H 2 SO 4 произойдёт с выделением SO 2 .
2Fe+6H 2 SO 4конц. Fe 2 (SO 4 ) 3 +3SO 2 +6H 2 O
![II группа Вывод: FeSO 4 +2NaOH Fe(OH) 2 +Na 2 SO 4 При взаимодействии сульфата железа (II) и гидрооксида натрия, образуется зелёный осадок Fe(OH) 2 Подгруппа №1: Подгруппа №2: 3FeSO 4 +2K 3 [Fe(CN) 6 ] Fe 3 [Fe(CN) 6 ] 2 +3K 2 SO 4 При взаимодействии сульфата железа (II) и гексацано (III) феррата калия, образуется гексациано феррат железа – синий осадок (турнбуленова синь). Это качественная реакция на ионы железа (II).](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img27.jpg)
II группа Вывод:
FeSO 4 +2NaOH Fe(OH) 2 +Na 2 SO 4
При взаимодействии сульфата железа (II) и гидрооксида натрия, образуется зелёный осадок
Fe(OH) 2
Подгруппа №1:
Подгруппа №2:
3FeSO 4 +2K 3 [Fe(CN) 6 ] Fe 3 [Fe(CN) 6 ] 2 +3K 2 SO 4
При взаимодействии сульфата железа (II) и гексацано (III) феррата калия, образуется гексациано феррат железа – синий осадок (турнбуленова синь). Это качественная реакция на ионы железа (II).
![III группа Вывод: FeCl 3 +3NaOH Fe(OH) 3 +3NaCl При взаимодействии хлорида железа (III) и гидрооксида натрия, образуется бурый осадок Fe(OH) 3 Подгруппа №1: Подгруппа №2: 4FeCl 3 +3K 4 [Fe(CN) 6 ] Fe 4 [Fe(CN) 6 ] +12Cl При взаимодействии хлорида железа (III) и гексацано (II) феррата калия, образуется гексациано феррат железа – тёмно-синий осадок (берлинская лазурь). Это качественная реакция на ионы железа (III).](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img28.jpg)
III группа Вывод:
FeCl 3 +3NaOH Fe(OH) 3 +3NaCl
При взаимодействии хлорида железа (III) и гидрооксида натрия, образуется бурый осадок
Fe(OH) 3
Подгруппа №1:
Подгруппа №2:
4FeCl 3 +3K 4 [Fe(CN) 6 ] Fe 4 [Fe(CN) 6 ] +12Cl
При взаимодействии хлорида железа (III) и гексацано (II) феррата калия, образуется гексациано феррат железа – тёмно-синий осадок (берлинская лазурь). Это качественная реакция на ионы железа (III).
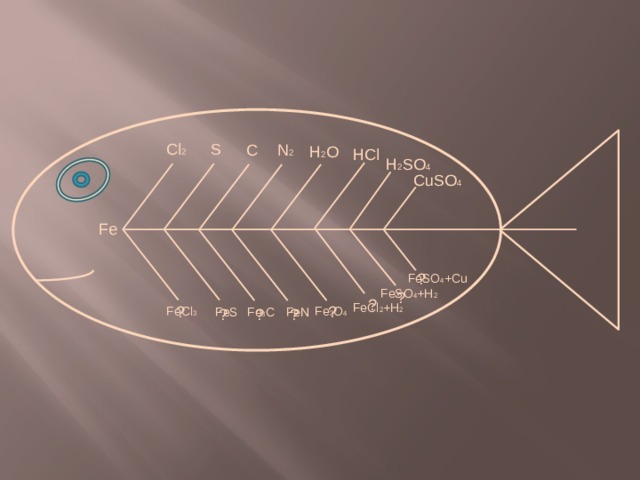
S
Cl 2
C
N 2
H 2 O
HCl
H 2 SO 4
CuSO 4
Fe
?
FeSO 4 +Cu
FeSO 4 +H 2
?
?
FeCl 2 +H 2
?
?
Fe 3 O 4
FeCl 3
FeS
?
?
?
Fe 3 C
FeN

БЛАГОДАРИМ ЗА ПРОСМОТР !!!




























![II группа Распознавание солей двухвалентного железа. Подгруппа №1 Подгруппа №2 В пробирке раствор FeSO 4 . В пробирке Раствор FeSO 4 . В капельнице раствор K 3 [Fe(CN) 6 ] В капельнице раствор NaOH. 1) Добавьте в пробирку с раствором FeSO 4 3-5 капель NaOH. (гексациано (III) феррат калия или красная кровяная соль). 1) Добавьте в пробирку с FeSO 4 . 3-5 капель K 3 [Fe(CN) 6 ]. 3) Пронаблюдайте. 2) Пронаблюдайте. 4) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 5) Впишите в таблицу наблюдения и уравнения реакций. 3) Составьте молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций в таблицу.](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img21.jpg)
![III группа Распознавание солей трёхвалентного железа. Подгруппа №1 Подгруппа №2 В пробирке раствор FeCl 3 . В пробирке раствор FeCl 3 . В капельнице K 4 [Fe(CN) 6 ] (гексациано (II) феррат калия или жёлтая кровяная соль). В капельнице раствор NaOH. 1) В пробирку FeCl 3 добавьте 3-5 капель NaOH. В Пробирку с FeCl 3 добавьте 3-5 капель K 4 [Fe(CN) 6 ]. 2) Пронаблюдайте. 2) Пронаблюдайте. 3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций. 3) Запишите молекулярное, полное ионное и сокращённое ионное уравнение. 4) Впишите в таблицу наблюдения и уравнения реакций.](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img22.jpg)




![II группа Вывод: FeSO 4 +2NaOH Fe(OH) 2 +Na 2 SO 4 При взаимодействии сульфата железа (II) и гидрооксида натрия, образуется зелёный осадок Fe(OH) 2 Подгруппа №1: Подгруппа №2: 3FeSO 4 +2K 3 [Fe(CN) 6 ] Fe 3 [Fe(CN) 6 ] 2 +3K 2 SO 4 При взаимодействии сульфата железа (II) и гексацано (III) феррата калия, образуется гексациано феррат железа – синий осадок (турнбуленова синь). Это качественная реакция на ионы железа (II).](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img27.jpg)
![III группа Вывод: FeCl 3 +3NaOH Fe(OH) 3 +3NaCl При взаимодействии хлорида железа (III) и гидрооксида натрия, образуется бурый осадок Fe(OH) 3 Подгруппа №1: Подгруппа №2: 4FeCl 3 +3K 4 [Fe(CN) 6 ] Fe 4 [Fe(CN) 6 ] +12Cl При взаимодействии хлорида железа (III) и гексацано (II) феррата калия, образуется гексациано феррат железа – тёмно-синий осадок (берлинская лазурь). Это качественная реакция на ионы железа (III).](https://fsd.multiurok.ru/html/2020/04/30/s_5eaa8f7b42589/img28.jpg)













