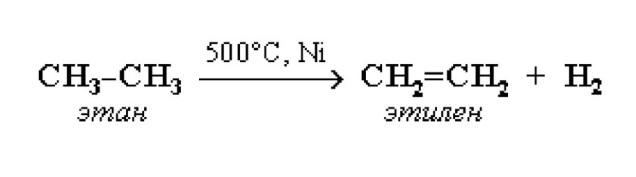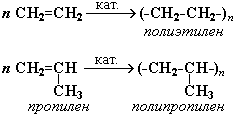Государственное бюджетное профессиональное образовательное учреждение «Починковский сельскохозяйственный техникум»
Открытый урок
«Непредельные углеводороды»
Выполнила:
Преподаватель ООД
Т.А. Могина
с.Починки
2022 г.
Цель урока:
Задачи урока:
Образовательные:
-
формирование знаний студентов о непредельных углеводородах и об алкенах как самостоятельном классе этих веществ, а также об особенностях их электронного строения, изомерии, номенклатуры, физических свойств;
-
показать место и значение алкенов среди углеводородов и в жизни человека;
Развивающие:
-
развивать умение обучающихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, устанавливать взаимосвязь строения и свойств веществ.
-
развивать внимание, познавательный интерес обучающихся к предмету путем формирования мотивов деятельности и использования разнообразных форм работы (коллективная, индивидуальная, парная).
Воспитательные:
-
воспитывать желание учиться активно, с интересом, прививать сознательную дисциплинированность, четкость и организованность в работе.
Форма проведения: урок-игра.
Тип урока: урок формирования новых знаний.
Презентация: «Непредельные углеводороды и их свойства» .
Ход урока
Любой человек, невзирая на возраст любит путешествовать. Вот и я Вас приглашаю совершить вместе со мной путешествие на прекрасном лайнере. Я – «капитан», Вы – пассажиры. Нам нужен штурман, который будет моим помощником. Его мы можем выбрать по количеству жетонов за отгаданный кроссворд.
Итак, начинаем. Чтобы определить- кто поведёт карабль? Необходимо ответить на вопросы кроссворда:
-
Процесс выравнивания S и P электронных облаков
-
Гомолог метана, формула которого C4H10.
-
Основной компонент болотного газа
-
Вещества относящиеся к одному классу, но отличающиеся друг от друга на одну или несколько групп -CH2
-
Вещества имеющие одинаковое число атомов, одну и ту же молекулярную массу, но различное химическое строение
-
Ученый, который получил этан из галогеннопроизводных предельных углеводород с металлическим натрием:
По итогам назначается Штурман.____________
Преподаватель: Итак корабль готов к выходу в плаванье. Отдать швартовый !
Преподаватель ставит перед штурманом задачу: на протяжении всего нашего плаванья следить за курсом, и за порядком на корабле.
Преподаватель:
Штурман, что у нас по курсу?
Штурман:
1. Форватор основных понятий.
Как нам его преодалеть?
Преподаватель: Чтобы выйти из бухты необходимо ответить на вопросы.
Работа обучающихся на местах:
1. Вопрос на доске.
- Из перечисленных веществ, выпишите формулы предельных УВ и дайте им названия:
C4H8, CH4, C5H12, C2H4, C3H6, C7H16, C8H18, C8H16, C5H10 .
!!!! Один учащийся тем временем записывает все возможные изомеры пентана.
Все вещества которые вы отметили относят к классу алканов. Давайте дадим характеристику класса, ответив на вопросы.
2. Вопрос на доске.
Заполните таблицу отвечая на вопросы:
-
Какова общая формула алканов?
-
Как называется первый представитель класса алканов?
-
В какой тип реакции не вступают алканы?
-
Виды связи?
-
Виды изомерии?
-
Как по-другому называется класс алканы?
| Признаки | Предельные УВ (насыщенные, алканы) |
| 1. Общая формула | CnH2n+2 |
| 2. Первый представитель класса | CH4 (метан) |
| 3. В какой тип реакции не вступают алканы | присоединения |
| 4. Виды связей | σ - связь |
| 6. Виды изомерии | Изомерия углеродного скелета |
| 7. Второе название класса алканы | Парафины |
Преподаватель: Штурман, что у нас дальше по курсу?
2. Море классов органических соединений
Преподаватель: Давайте вспомним с Вами реакцию дегидрирования алканов.
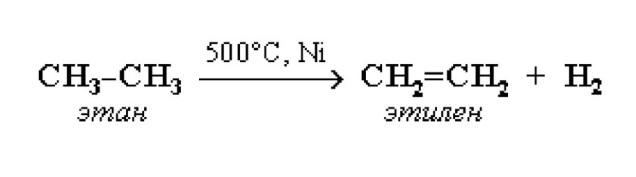
-
Будет ли углеводород, который получился в ходе реакции , относиться к предельным углеводородам (УВ)?
Почему? - Не отвечает общей формуле алканов
-
Является ли данный углеводород насыщенным? - Данный УВ не является насыщенным.
Для чего же он нужен?
Данный УВ используют широко для обработки фруктов и овощей, чтобы ускорить их созревание. Сегодня его широко применяют для получения многих видов пластмасс. Это, как уже написано было на слайде, этилен.
Преподаватель: Как вы думаете, какую тему урока мы сегодня будем изучать?
Записать тему в тетрадь.
Тема: «Алкены. Общая характеристика. Получение алкенов и их свойства.
Цель нашего сегодняшнего урока изучить класс непредельных углеводородов. Дать краткую характристику.
Сообщение учащегося об истории открытия и истории названия этилена.
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635–1682)… случайно! В одном из опытов он вместо добавления к нагретому купоросному маслу (концентрированной серной кислоте) еще одной его порции в рассеянности прилил винный спирт (этанол), который находился рядом в стакане. Бехер увидел сильное вспенивание раствора с выделением неизвестного газа, похожего на метан СН4. В отличие от метана новый газ горел коптящим пламенем и обладал слабочесночным запахом. Бехер установил, что его “воздух” более химически активен, чем метан. Так был открыт этилен С2Н4.
Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор в процессе реакции. До этого в научной практике применялись только биологические катализаторы природного происхождения – ферменты. Этилен более 100 лет после его открытия не имел собственного названия.
В конце ХVIII века выяснилось, что при взаимодействии с хлором “газ Бехера” превращается в маслянистую жидкость; после чего его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, которые имели подобное этилену строение. И только в середине XIX в. “газ Бехера” получил название “этилен”, которое дал ему А.М. Бутлеров. Это название и осталось в химии до наших дней.
Преподаватель: Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов - CnH2n.
Мы видим, что в соединении встречается двойная связь.
а) двойная связь является сочетанием сигма- и пи-связей, различающихся своей прочностью.
б) наличие пи-связи (более слабой) объясняет высокую химическую активность алкенов.
Преподаватель: Ну, что ж, кое-что мы уже узнали. Штурман, что у нас дальше по курсу?
3. Рифы химических формул
Задание группе:
Гомологический ряд алкенов.
Составить молекулярные формулы первых семи представителей ряда этена у себя в тетради.
Существует ли алкен с одним атомом углерода?
Номенклатура алкенов.
2. Назовите непредельный углеводород.
СН2
||
СН3 – СН2 – СН2 – С– СН2 – СН3 (2- этилпентен-1)
Преподаватель: Давайте запишем с вами правило названия алкенов.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
Запомни!!!
Названия одновалентных радикалов алкенов: -СН=СН2 (винил) –СН2–СН=СН2 ( аллил )
Изомерия. (Предложить учащимся ответить на вопросы)
1. Какие виды изомерии характерны для алкенов?
- изомерия углеродного скелета.
- изомерия положения двойной связи.
- межклассовая изомерия.
Алкены изомерны цикло-алканам. Это еще один класс углеводородов, но уже циклический.
Эти изомеры отличаются физическими и химическими свойствами атомов.
Физические свойства алкенов.
Изменение физических свойств происходит вслед за возрастанием Mr веществ.
По физическим свойствам алкены близки к алканам, т.к. их молекулы также практически неполярны. С воздухом этилен образует взрывоопасные смеси. Жидкие алкены имеют неприятный специфический запах.
Распространение в природе. В отличие от предельных УВ алкены в природе, как правило, не встречаются, что объясняется их высокой химической активностью. Этилен может входить в состав природного и попутного газов, правда содержание его невелико (0,5- 4%). Газообразные алкены выделяют из газов нефтепереработки, а также из газов коксообразования угля.
Преподавательь: Штурман, что у нас дальше по курсу?
4. Залив знаний
Чтобы преодолеть это испытание нам необходимо познакомится с химическими свойствами алкенов.
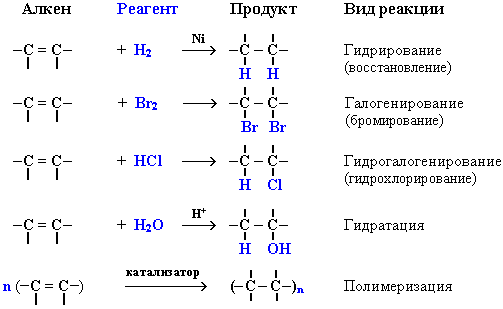
Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:
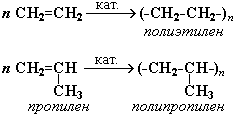
Получение алкенов.
-
Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
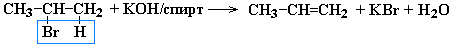
-
Дегидратация спиртов при температуре менее 150°C в присутствии водоотнимающих реагентов

Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Преподаватель: Капитан, что дальше по курсу?
Капитан:
5. Порт
Преподаватель:
Итак, мы подошли в конечный пункт нашего путешествия – порт.
Давайте подведём итог нашему путешествию, ответив вопросы :
-
Что мы узнали в ходе путешествия?
-
Где встретились затруднения на нашем пути?
-
С каким настроением Вы вернулись в Порт? (поднимите смайлик)
Обучающиеся отвечают на вопросы, преподаватель выставляет оценки за урок.
Домашнее задание
Преподаватель: Домашнее задание я вам скинула в нашу общую беседу в социальной сети в ВКонтакте.
-
Хамитова, А. И. Органическая химия для студентов СПО : учебное пособие / А. И. Хамитова, Т. Е Бусыгина, Л. Р. Сафина. — Казань : Казанский национальный исследовательский технологический университет, 2016. — 172 c.
Стр. 12-15
2. Стр.15 Задания для самостоятельной работы № 1,2,3.
Спасибо за внимание!
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635–1682)… случайно! В одном из опытов он вместо добавления к нагретому купоросному маслу (концентрированной серной кислоте) еще одной его порции в рассеянности прилил винный спирт (этанол), который находился рядом в стакане. Бехер увидел сильное вспенивание раствора с выделением неизвестного газа, похожего на метан СН4. В отличие от метана новый газ горел коптящим пламенем и обладал слабочесночным запахом. Бехер установил, что его “воздух” более химически активен, чем метан. Так был открыт этилен С2Н4.
Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор в процессе реакции. До этого в научной практике применялись только биологические катализаторы природного происхождения – ферменты. Этилен более 100 лет после его открытия не имел собственного названия.
В конце ХVIII века выяснилось, что при взаимодействии с хлором “газ Бехера” превращается в маслянистую жидкость; после чего его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, которые имели подобное этилену строение. И только в середине XIX в. “газ Бехера” получил название “этилен”, которое дал ему А.М. Бутлеров. Это название и осталось в химии до наших дней.