Государственное образовательное учреждение дополнительного профессионального образования (повышения квалификации) специалистов «Кузбасский региональный институт повышения квалификации и переподготовки работников образования»
Факультет повышения квалификации
Кафедра естественно-научных и математических дисциплин
Итоговая работа
Методические рекомендации по подготовке
учащихся к итоговой аттестации по химии.
Срок обучения с «26» февраля 2019 г. по «16» марта 2019 г.
|
| Исполнитель: |
|
| Барсуков Дмитрий Борисович |
|
| учитель химии, |
|
| МБОУ «СОШ № 92», г. Кемерово |
|
| 8-913-077-39-47 [email protected] Белоножко Нина Викторовна учитель химии, ГСУВОУ «ГСОШ», тонкинский район 8-950-270-36-48 nina.belonozhko@yandex.ru Кудрешова Ольга Александровна учитель химии, МБОУ «СОШ № 15», г. Кемерово 8-923-603-24-72 nina.belonozhko@yandex.ru
|
Кемерово, 2019
Оглавление
Введение 3
Характеристика заданий 4
Требование к подготовке 5
Требование по подготовке к заданию №20 5
Требование подготовки к заданию №21 8
Требование подготовки к заданию №22 10
Заключение 16
Литература 17
Приложение 18
Введение
Согласно Закону Российской Федерации “Об образовании в РФ” освоение общеобразовательных программ основного общего и среднего общего образования завершается обязательной итоговой аттестацией выпускников общеобразовательных учреждений независимо от формы получения образования.
Государственная итоговая аттестация выпускников 9 и 11 классов стала важнейшей частью нашей жизни. И это вполне понятно: несколько напряженных дней в мае—июне способны определить будущее ребенка — кому-то они откроют дорогу в престижный техникум, вуз, а кому-то принесут разочарование. Какие результаты будут получены в ходе итоговой аттестации, во многом зависит от предварительной подготовки школы к этому напряженному и очень ответственному периоду.
Новые формы проведения итоговой аттестации школьников (ЕГЭ и ОГЭ) имеют ряд преимуществ. Для выпускников это возможность получить объективную оценку своих знаний, а также предоставление реальных шансов поступления в вуз, для учителей – возможность скорректировать свою работу в целях достижения более высоких и стабильных результатов.
Качественная подготовка выпускников к экзаменационным испытаниям предусматривает проведение не отдельных мероприятий, а целого комплекса последовательных и взаимосвязанных направлений работы, объединённых в программу подготовки. Подготовка к итоговой аттестации включает в себя формирование и развитие психологической, педагогической и личностной готовности у всех участников итоговой аттестации.
Цель работы: методическая рекомендация и систематизация опыта работы по подготовке учащихся к итоговой аттестации с использованием требований к оцениванию к заданиям.
Характеристика заданий
Назначение контрольных измерительных материалов (КИМ) для основного государственного экзамена (ОГЭ) – оценить уровень общеобразовательной подготовки по химии выпускников IX классов общеобразовательных организаций в целях государственной итоговой аттестации выпускников.

Задания второй части проверяют усвоение следующих элементов содержания:
способы получения и химические свойства различных классов неорганических соединений,
реакции ионного обмена,
окислительно- восстановительные реакции, взаимосвязь веществ различных классов,
количество вещества, молярный объем и молярная масса вещества, массовая доля растворенного вещества.
Выполнение заданий этого вида предполагает сформированность комплексных умений:
− составлять электронный баланс и уравнение окислительно- восстановительной реакции;
− проводить комбинированные расчеты по химическим уравнениям.
− объяснять обусловленность свойств и способов получения веществ их составом и строением, взаимосвязь неорганических веществ.
Требование к подготовке Требование по подготовке к заданию №20
Задание № 20. Критерии оценивания
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
Элементы ответа:
| 1 | Составлен электронный баланс | 1 балл |
| 2 | Расставлены коэффициенты в уравнении реакции | 1 балл |
| 3 | Указаны окислитель и восстановитель | 1 балл |
| 4 | Максимальный: | 3 балла |
Допустимые варианты ответов
N+5, O -2, Br 0 , Br -1
 2 Fe+3 + 1e → Fe+2 окислитель, восстановление
2 Fe+3 + 1e → Fe+2 окислитель, восстановление
1 2I -1 - 2e → I2 0 восстановитель, окисление

 + 1e -2е
+ 1e -2е
2 Fe +3 → Fe+2 1 2I -1 → I2 0
ок-ль - 2e или восст-ль +1е
1 2I -1 → I2 0 2 Fe +3 → Fe+2
восст-ль ок-ль
Допускается указание типа частиц (окислитель и восстановитель) в уравнении реакции (это может быть записано в сокращенной форме)
Указано, что железо в степени окисления +3 (Fe +3 ) является окислителем, а йод в степени окисления -1 ( I -1) (или КI) - восстановителем;
Допустимо удвоение, утроение коэффициентов
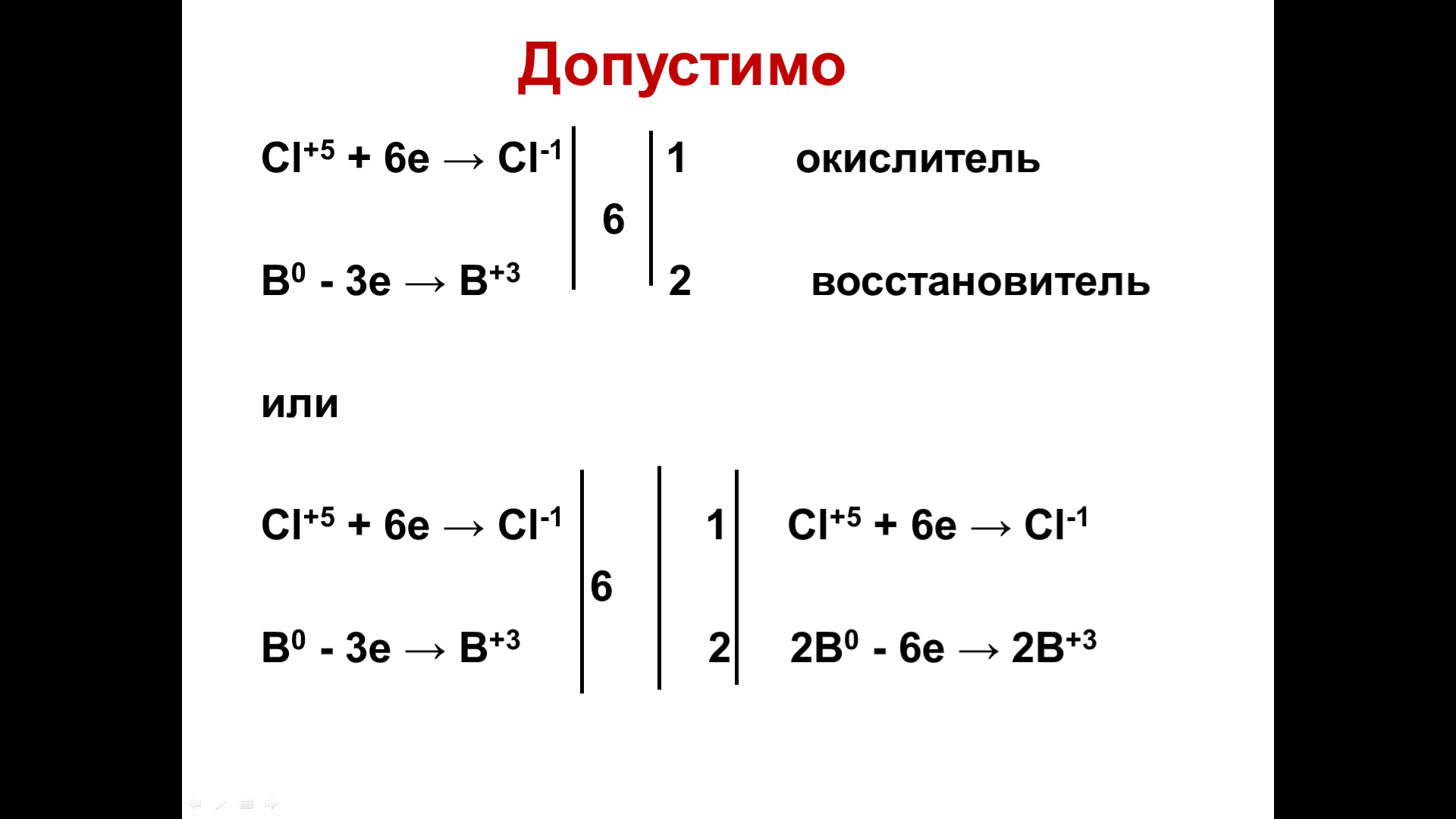
Задача:
Используя метод электронного баланса, составьте уравнение реакции
H2SO4 (конц) + Zn → ZnSO4 + Н2S + Н2O . Определите окислитель и восстановитель.
1) Составлен электронный баланс:
4 Zn0 - 2e →Zn+2 (допустимо: Zn2+ ,S 6+ )
1 S +6 + 8e →S-2
2) Указано, что сера в степени окисления +6 (или H2SO4 ) является окислителем, а цинк в степени окисления 0 (или Zn0 ) - восстановителем;
3) Составлено уравнение реакции:
5H2SO4 (конц) + 4Zn → 4ZnSO4 + Н2S + 4Н2O
Допускаемые ошибки
1. Неправильное определение степени окисления
2. Неправильное определение типа частиц: окислитель или восстановитель
3. Неправильное определение процессов окисления и восстановление
Например :
Fe+3 + 1e → Fe+2 окисление
2I -1 - 2e → I2 0 восстановление
Неправильное определение коэффициентов
Уравнения, вызывающие ошибки
1. Участие веществ в молекулярной форме
2. Участие перекиси водорода
неправильно определена степень окисления кислорода
Н2О2-2
3. Участие в процессе аммиака неправильное определение степени окисления азота и водорода
N+3H3-1
Усложненные реакции
Ca(ClO)2 + Na2S + H2O = CaCl2 + S + NaOH
AlP +HNO3 = H3PO4 + Al(NO3)3 + NO2 + H2O
C + SiO2 + Ca3 (PO4) 2 = P + CO + CaSiO3
MnO + KClO3 + KOH = K2MnO4 + KCl + H2O
Cr2O3 + NaNO3 + Na2 CO3 = Na2 CrO4 + NaNO2 + CO2
KCrO2 + Cl2 +KOH = K2CrO4 + KCl + H2O
Требование по подготовке к заданию №21
План решения задачи:
1. Составить уравнение реакции.
2. Установить логические связи («что ищу, по чему считаю»)
3. Расчет по пропорции или по молям
Типы задач
1. Нахождение массы выпавшего осадка
2. Вычисление объема газа, участвующего в реакции или выделившегося в результате реакции
3. Вычисление массы исходного вещества, находящегося в растворе, взятого для реакции
4. Вычисление массы раствора, в котором находится исходное вещество
Оценка задачи 3 балла
Допустимые варианты ответов
Задача решена методом пропорции
Отдельно указаны расчеты молярных масс веществ
При расчетах атомные массы хлора и меди указаны как:
Ar(Cl)=35,5, Ar(Cu)= 64 или 63,5
В конечных расчетах указаны единицы измерения (г, моль, л)
Типичные ошибки
1) Математические (снимается 1 балл)
2) Неправильно составлены формулы веществ, (снимается 1 балл)
3) Неправильно расставлены коэффициенты (снимается 1 балл)
4) Перепутаны местами исходные вещества и продукты реакции (снимается 1 балл)
5) Не поставлены размерности в цифрах ответа (г, л) (снимается 1 балл)
Примеры задач
Избыток цинка поместили в 18,25г раствора соляной кислоты с массовой долей хлороводорода 10%. Какой объем (н.у.) водорода выделится при этом?
В результате взаимодействия раствора нитрата кальция и избытком раствора карбоната натрия выпал осадок массой 20г. Чему равна масса раствора нитрата кальция с массовой долей 4%, взятого для проведения этой реакции?
Какой объем аммиака может полностью прореагировать с хлороводородом, находящемся в растворе соляной кислоты массой 182,5г с массовой долей HCl 10%?
Требование по подготовке к заданию №22
Проверяемые элементы содержания:
Химические свойства простых веществ
Химические свойства сложных веществ
Взаимосвязь различных классов неорганических веществ
Реакции ионного обмена и условия их осуществления
Требования к уровню подготовки учеников
Определять
- возможность протекания реакций ионного обмена
- признаки реакций
Составлять
- уравнения химических реакций
- сокращенное ионное уравнение реакции
Смысл: составить алгоритм последовательных действий получения заданного вещества
Если для первого превращения составлено уравнение реакции, которая практически неосуществима, то следующие элементы ответа не рассматриваются и за выполнение всего задания выставляется 0 баллов
Задание № 22 Критерии оценивания
Элементы ответа:
| 1 | Первое уравнение синтеза | 1 балл |
| 2 | Признак первой реакции | 1 балл |
| 3 | Второе уравнение синтеза | 1 балл |
| 4 | Признак второй реакции | 1 балл |
| 5 | Сокращенное ионное уравнение | 1 балл |
|
| Максимальный | 5 баллов |
Допустимые варианты ответов признаков реакций:
Выделение бесцветного газа, газа с резким запахом
Выделение газа,
Растворение осадка, выделение бесцветного газа
Растворение осадка, образование прозрачного раствора
Для Fe(OH)2: выпадение серо-зеленого осадка
(осадка болотного цвета)
Выделение красного осадка металлической меди
Видимых изменений нет (при образовании воды)
Растворение черного осадка (для CuO)
Сокращенное ионное уравнение реакции
Запись зарядов ионов: Mg2+, ОН - , Н+, SO42-
2 Н+ + 2 ОН- = 2Н2О
Н+ + ОН- = Н2О
Коэффициент 2 обязательно сокращается!
Примеры решения задач:
Для проведения эксперимента предложены следующие реактивы: KNO3, MgSO4, ВаСl2, КОН, NaCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид калия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для первой реакции напишите сокращенное ионное уравнение реакции.
Решение:
1) 2КОН + MgSO4 = K2SO4 + Mg(OH)2 ↓
2) K2SO4 + ВаСl2 = 2KCl + BaSO4 ↓
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выпадение белого осадка;
5) Ионное уравнение:
Mg2+ + 2ОН - = Mg(OH)2 ↓
Для проведения эксперимента предложены следующие реактивы: Аl, NH3(p-p); растворы: ВаСl2, Al2(SO4)3 Н2О2, НСl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид алюминия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение:
Al2(SO4)3 + 6NH3 *H2O = 2Аl(ОН)3↓ + 3(NH4)2SO4
или Al2(SO4)3 + 6NH4OН = 2Аl(ОН)3↓ + 3(NH4)2SO4
или 2Al + 6H2O = 2Аl(ОН)3↓ + 3H2↑
2) Аl(ОН)3 + ЗНСl = АlСl3 + ЗН2O
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: растворение осадка и образование прозрачного раствора;
5) Аl(ОН)3 + ЗН+ = Аl3+ + ЗН2O
3. Для проведения эксперимента предложены следующие реактивы: СuO, FeSO4, Сu, H2O2,NaOH, раствор H2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Решение:
1) CuО + H2SO4 = CuSO4 + H2О
2) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Признаки протекания реакций:
3) для первой реакции: растворение черного осадка и образование раствора голубого цвета;
4) для второй реакции: образование голубого осадка;
5) Cu2+ + 2OН- = Сu(ОН)2
4. Для проведения эксперимента предложены следующие реактивы: (СuOН)2СО3, Fe, К3РO4, Сu, NaOH, раствор HСl. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для первой реакции напишите сокращённое ионное уравнение реакции.
Решение:
1) (СuOН)2СО3 + 4HСl = 2CuСl2 + 3H2О + СО2
2) CuСl2 + 2NaOH = Cu(OH)2 + 2NaСl
Признаки протекания реакций:
3) для первой реакции: растворение зеленой соли, выделение бесцветного газа и образование раствора сине-зеленого цвета;
4) для второй реакции: образование голубого осадка;
5) (СuOН)2СО3 + 4H + = 2Cu2+ + 3H2О + СО2
Для проведения эксперимента предложены следующие реактивы: ВаСl2, CuSO4, K2SO4, AgNO3, KOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат калия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Задача имеет несколько вариантов решения. Предлагается ребятам найти как можно больше решений при подготовке. Это развивает логического мышление и вариативность решения.
Решение 1:
ВаСl2 + K2SO4 = 2КСl +ВаSO4
2) КСl + AgNO3 = КNO3 + AgСl
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выпадение белого осадка;
5) Ag + + Сl - = AgСl
Решение 2:
CuSO4 + 2КOH = К2SO4 + Cu(OH)2
2) К2SO4 + 2AgNO3 = Ag2 SO4 + 2КNO3
Признаки протекания реакций:
3) для первой реакции: выпадение голубого осадка;
4) для второй реакции: выпадение белого осадка;
5) SO4 2- + 2Ag+ = Ag2 SO4
Решение 3:
ВаСl2 + 2AgNO3= 2AgСl +Ва(NO3) 2
2) Ва(NO3)2 + K2SO4 = 2КNO3 + ВаSO4
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выпадение белого осадка;
5) Ва 2+ + SO4 2 - = ВаSO4
Решение 4:
CuSO4 + 2AgNO3= Ag2SO4 + Cu(NO3)2
2) Cu(NO3)2 + 2КOH = Cu(OH)2 + 2КNO3
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выпадение голубого осадка;
5) Cu2+ + 2OН- = Сu(ОН)2
Заключение
Таким образом, можно сделать следующие выводы, что для подготовки выпускников средних общеобразовательных учебных заведений к успешной сдаче итоговой аттестации по химии учителю вместе с учащимися необходимо проанализировать структуру и содержание теста, в соответствии с которым и проводится итоговое испытание.
Литература
1.Методические материалы для председателей и членов региональных предметных комиссий по проверке выполнения заданий с развернутым ответом экзаменационных работ ОГЭ 2018 года. Добротин Д.Ю. Москва,2019
2. https://chem-ege.sdamgia.ru/
3. http://www.fipi.ru/
4.https://drofa-ventana.ru/upload/iblock/a25/a258c1dab1d4687e8f8ef1837a47f59d.pdf
Приложение
Экспериментальный вариант задания №22
1. Даны вещества: нитрат бария, нитрат серебра, хлорид бария, соляная кислота, карбонат кальция. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат кальция. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
2. Даны вещества: нитрат серебра, сульфат цинка, медь, оксид меди (II), гидроксид натрия, раствор серной кислоты. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II) . Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
3. Даны вещества: железо, сульфат железа(II) , сульфат магния, гидроксид натрия, хлорид бария, раствор серной кислоты . Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II) . Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
4. Даны вещества: нитрат серебра, сульфат цинка, медь, гидроксид натрия, раствор серной кислоты, хлорид меди (II) . Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
5. Даны вещества: нитрат серебра, хлорид алюминия, соляная кислота, цинк, сульфат цинка, гидроксид натрия. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Разбор примеров работ учащихся
Примеры выполнения задания 20
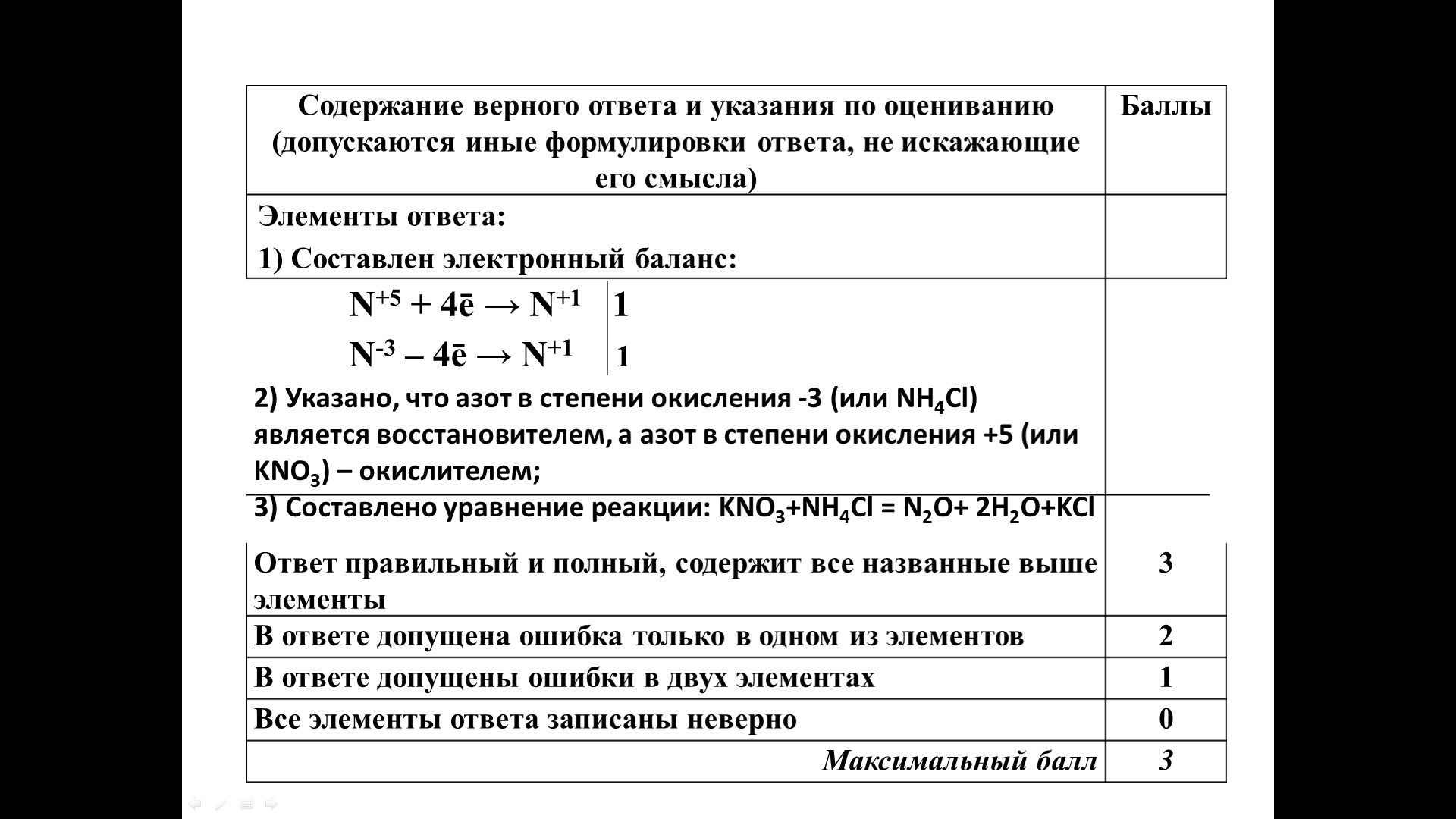
Используя метод электронного баланса, составьте уравнение реакции
KNO3 + NH4Cl → N2O + H2O + KCl
Определите окислитель и восстановитель.



Примеры выполнения задания 21
Через раствор нитрата меди(II) массой 37,6г. и массовой долей 5% пропустили избыток сероводорода.
Вычислите массу осадка, образовавшегося в результате реакции.

Представленное решение - наглядный пример того, насколько существенно может отличаться решение, предлагаемое учеником, от решения, представленного в эталоне ответа. В целом ошибок в решении задания учащийся не допустил. Все расчеты проведены верно. Основания для снижения оценки нет. (3 балла)

В данном примере задача решена способом, отличающимся от представленного в эталоне ответа: решение выполнено с помощью пропорции. Все необходимые вспомогательные вычисления выполнены правильно.
(3 балла)

При решении задачи учащийся также составил пропорцию. Однако уже на первом этапе решения неверно определил массу растворенного вещества, содержащегося в растворе.
Именно эта ошибка привела в итоге к получению неверного ответа. Признать данную ошибку учащегося только как ошибку в вычислениях было бы неверным, т.к. она допущена из-за неполного владения им понятием «массовая доля растворенного вещества». Есть ошибки и в расчетах относительных молекулярных масс веществ.
В то же время итоговая пропорция составлена и решена (с учетом уже сделанной ранее ошибки) верно.
(1 балл)

В данном решении задания ошибка допущена при составлении формулы нитрата меди(II), что привело к неверному составлению уравнения реакции и неверному расчету относительной молекулярной массы данного вещества, а так как эта величина используется и на завершающем этапе расчетов, то в результате (в итоговом значении ответа) также допущена ошибка. Таким образом, верно выполненным является только второй элемент решения. (1 балл)
Примеры выполнения задания 22
Предложены следующие реактивы: оксид магния и растворы сульфата магния, хлорида бария, хлорида меди(II), серной кислоты и соляной кислоты.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида магния. Запишите уравнения двух реакций, указав признаки каждой реакции. Для второй реакции составьте сокращённое ионное уравнение
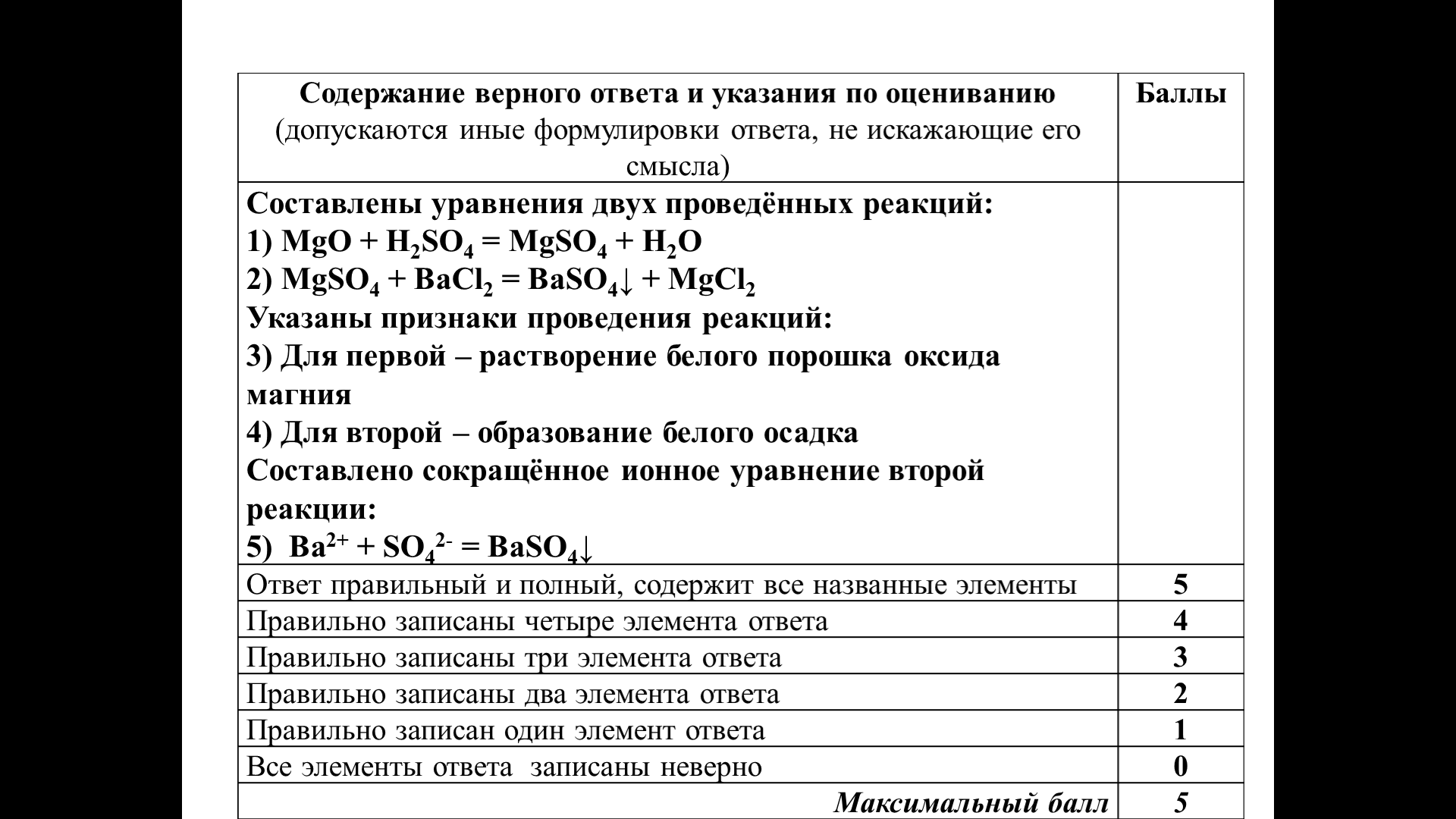

Верно записаны два молекулярных и одно сокращённое ионное уравнение, верно указаны признаки протекания обеих химических реакций.
Итоговая отметка за запись задания – 5 баллов.

В предложенном решении учащийся верно записал два молекулярных уравнения реакции и сокращённое ионное уравнение.
В качестве верных можно засчитать и признаки протекания обеих химических реакций (хотя в первом случае есть указание на изменение цвета, которое не происходит).
Таким образом, за запись решения заданий - 5 баллов.

24








 2 Fe+3 + 1e → Fe+2 окислитель, восстановление
2 Fe+3 + 1e → Fe+2 окислитель, восстановление























