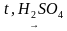Общие положения техники безопасности на уроках химии
Химия – предмет, который предполагает изучение и работу с химическими веществами.
Во время урока, при работе учащихся могут иметь место вредные и опасные факторы:
отравление химическими веществами;
получение химических ожогов агрессивными веществами;
травмирования осколками стекла;
травмирования в результате взрыва или самовозгорания химических веществ, при нарушении условий их хранения.
Поэтому на уроках химии учащимся, прежде всего, нужно усвоить «химическую практику» и правила безопасного обращения с химическими веществами.
Это означает, что:
учащиеся обязаны знать свойства веществ, с которыми они работают и безопасные приемы обращения с ними;
выполнять требования безопасности при обращении со стеклянной посудой и ампулами;
знать правила обезвреживания и уничтожения вредных веществ;
выполнять только порученную учителем работу;
выполнять правила эксплуатации используемого оборудования;
соблюдать правила личной гигиены;
содержать рабочее место в чистоте;
правильно применять средства индивидуальной и коллективной защиты;
знать и соблюдать требования пожарной безопасности и уметь пользоваться средствами пожаротушения;
немедленно извещать учителя о любой ситуации, угрожающей здоровью и жизни людей (учеников), об инциденте или ухудшении состояния своего здоровья;
уметь оказывать первую (доврачебную) помощь при несчастных случаях (отравлении, термическом и химическом ожогах).
В кабинете химии должны быть в наличии:
аптечка, содержащая медикаменты для оказания первой медицинской помощи;
раствор для нейтрализации токсичных веществ, применяемых в работе;
средства индивидуальной защиты;
средства пожаротушения (огнетушитель, ящик с песком). Тара, в которой хранятся химические вещества должна иметь четкие надписи.
В кабинете химии ЗАПРЕЩАЕТСЯ:
выполнение работ, не связанных с заданием или во внеурочное время;
хранение химических веществ в таре, не имеющей надписи;
совместное хранение в непосредственной близости друг к другу веществ, которые могут вызвать в результате химического взаимодействия пожар или взрыв;
хранение химических веществ в количествах, превышающих суточную норму;
применение химической посуды для личного пользования;
бегать и прыгать;
принимать пищу.
Практическая работа № 2
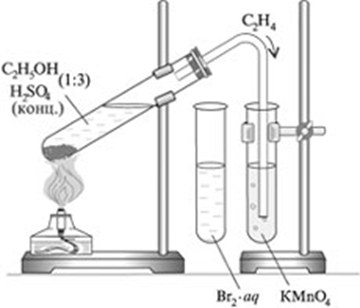
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
| № п/п | Название опыта | Описание опыта, рисунок | Наблюдения и уравнения реакций | Вывод |
| 1. | Получение этилена. | В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки. 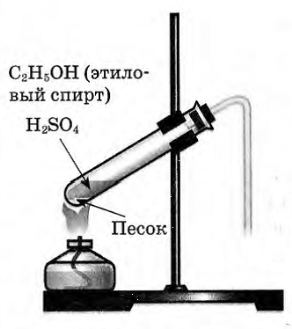 | В пробирке начинается выделяться газ - этилен. С2H5OH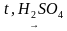 C2H4↑ + H2O. C2H4↑ + H2O.
| В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен. Такую реакцию называют – реакция дегидратации.
|
| 2. | Изучение свойств этилена. | В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ. 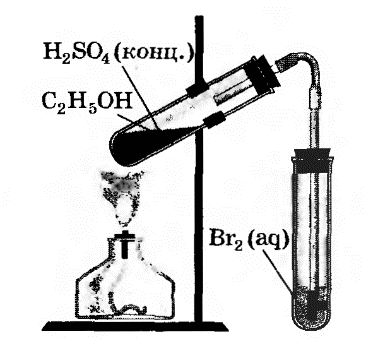 | При пропускании газа через бромную воду, происходит обесцвечивание бромной воды. H2C=CH2 + Br2 → CH2Br – CH2Br | В ходе реакции происходит окисление этилена бромной водой по двойной связи. |
| В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ. 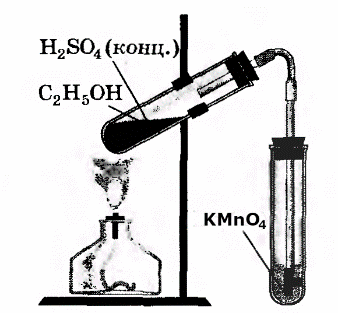
| При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4. 5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+ +12MnSO4+28H2O. | В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия. |
| Выделяющиеся газ первой пробирки подожгли. 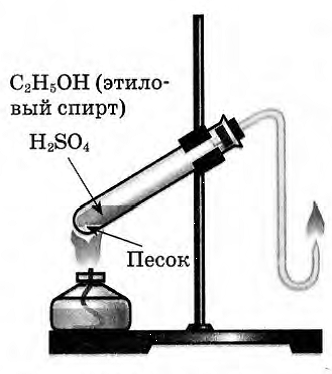 | Этилен на воздухе горит ярким светящимся пламенем. С2Н4 + 3О2 → 2СО2+2Н2О. | Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей. |
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
| Какой из гомологов этена имеет плотность по воздуху 1,45? Ответ: D(возд.) = Mr (алкена)/Mr (воздуха); Mr (алкена) = D(возд.)* Mr (воздуха); Mr (алкена) = 1,45*29 = 42. Пропен Н2С=СН-СН3
| Какой из гомологов пропена имеет плотность по водороду 14? Ответ: D(Н2) = Mr (алкена)/Mr (Н2); Mr (алкена) = D(Н2)* Mr (Н2); Mr (алкена) = 14*2 = 28. Этен СН2=СН2
|