Конспект урока учитель Дынженова ГД
Тема: Получение оксида углерода (IV) и изучение его свойств.
Цель урока: получить в лаборатории оксид углерода (IV) и экспериментально подтвердить теоретические знания о его свойствах. Провести качественные реакции на карбонат-ионы, идентифицировать вещества, используя знания о качественных реакциях
Задачи урока:
Образовательные
Закрепить теоретические знания о свойствах оксида углерода (IV) и карбонатов.
Закрепить знания о качественных реакциях на карбонат-ионы, сульфат и хлорид-ионы.
Продолжить формирование навыков решения экспериментальных задач на распознавание веществ
Развивающие
Совершенствовать умения экспериментально подтверждать химические свойства веществ на основе теоретических знаний, выявлять существенное, делать выводы.
Развивать умения анализировать условие задачи, разрабатывать план решения, умения наблюдать, оценивать полученные результаты. Развивать коммуникативные навыки. Воспитательные
Воспитывать аккуратность, самостоятельность, инициативность, убежденность в необходимости соблюдения правил техники безопасности.
Лабораторное оборудование и реактивы: лабораторный штатив, прибор для получения газов, химические стаканы на 50 мл, кусочки мрамора, соляная кислота (1:2), известковая вода, дистиллированная вода, сода, уксусная кислота (лимонная), пластиковая бутылка, свечи, стеклянные трубочки, пробирки, склянки с сульфатом натрия, хлоридом натрия, карбонатом натрия.
Методы обучения:
Форма обучения: практическая работа
ХОД УРОКА
I. Организационно-мотивационный этап
Здравствуй, ребята! Мы в очередной раз с вами собрались в кабинете химии. Думаю, что вас всех интересует тема нашего урока. Для того, чтобы узнать тему нашего урока, предлагаю посмотреть одно видео. Только попрошу посмотреть данное видео как человек, изучающий химию.
Видео ВИА «Земляне» - песня «Трава у дома»
Что вы заметили, просматривая видео?
Дым на сцене
Слайд 1
Это спецэффект. Вы наверное, такой спецэффект видели не раз - на различных концертах и праздниках, театральных постановках и ТВ-съемках. Кто знает, что это за газ, который стелется по полу как воздушный мягкий ковёр?
Углекислый газ или оксид углерода (IV)
Слайд 2
Если жидкую углекислоту из баллона, где она находится под большим давлением, вылить наружу, то она начинает стремительно испаряться. При испарении температура жидкости понижается, и не успевшая испариться вылившаяся углекислота замерзнет. В результате получится рыхлый углекислый "снег"– замерзший углекислый газ.
Современные установки выпускают сухой лед в виде крошки, гранул и брикетов. Сухой лед обладает странным свойством – испаряться без перехода в жидкое состояние. Этот процесс называется «возгонка» или «сублимация». Испаряющийся при этом газ имеет очень низкую температуру и конденсирует в воздухе водяные пары, поэтому присутствие углекислого газа в воздухе можно определить косвенно по наличию тумана
Слайд 3
Сухой лед используется в технике, медицине и пищевой промышленности, в первую очередь, конечно, для охлаждения, хранения и перевозки пищевых продуктов, которые в углекислом газе не плесневеют и не гниют.
Слайд 4
Итак, тема нашего практического занятия «Получение оксид углерода (IV) и изучение его свойств. » (Ученики записывают на распечатках)
Цель: получить углекислый газ в лаборатории , экспериментальным путем подтвердить теоретические знания о его свойствах. Распознавать (идентифицировать) вещества
используя знания о качественных реакциях
Подготовка к изучению материала. Углекислый газ образуется при дыхании всего живого: растений, животных, микроорганизмов, а также он образуется при гниении, брожении и горении углеродсодержащих веществ. Углекислый газ содержится в составе вулканических газов, выделяется он из Земли в вулканических местностях. Возникает вопрос: А можно ли получить углекислый газ в лаборатории? Как доказать, что получен углекислый газ? Вы хотели бы ответить на эти вопросы?
Тогда приступаем к поиску ответов на эти вопросы
Прежде чем приступить к работе , я должна быть уверена, что вы помните меры предосторожности при работе с реактивами. Посмотрите в лотки.
Слайд 5 Правила техники безопасности
Слайд 6 диоксид углерода, оксид углерода (IV), угольный ангидрид, углекислый газ
Выберите свойства характерные для углекислого газа
Диоксид углерода (двуокись углерода, углекислый газ, оксид углерода (IV), диоксид углерода, угольный ангидрид, углекислота) — CO2
1.Кристаллическое вещество
2. Бесцветный газ со слегка кисловатым запахом и вкусом
3.Поддерживает горение
4. Выделяется в атмосферу с дыханием
5. Не поддерживает горение
6. Намного легче воздуха
7. Растения поглощают углекислый газ в процессе фотосинтеза
8. Примерно в 1,5 раза тяжелее воздуха
9.Не растворим в воде
10. Большая концентрация в воздухе вызывает удушье
11.Хорошо растворим в воде
12.Концентрация в атмосфере Земли составляет 0,038 %.
II. Поисковый этап
Слайд 7(фото лимонная кислота и сода)
Вот эти вещества вам знакомы? У всех есть на кухне эти вещества? А когда ваша мама их использует? ( в рецептах указано «добавить чайную ложку гашеную уксусом»)
( В пластиковых бутылках находится пищевая сода + лимонная кислота добавить воды) плотно закрываем крышкой. Наблюдаем бурное выделение углекислого газа.
А как доказать, что образовался углекислый газ?
В нашем первом эксперименте при реакции с углекислым газом известковая вода становится мутной. Это характерная реакция для углекислого газа, то есть она позволяет идентифицировать углекислый газ.
CO2 + Ca(OH)2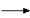 CaCO3
CaCO3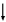 + H2O
+ H2O
В данном случае можно известковой водой обнаружить его?
Обнаружить, это значит определит его по свойствам.
Вспомним свойства углекислого газа?
(Это газ тяжелый, он не поддерживает горение)- проверим это на практике
(Зажигаем свечу, помещенную в стакан с помощью лучинки и «выливаем» на пламя полученный газ.)
На практике используется это свойство углекислого газа? При тушении пожаров. В огнетушителе находится сжиженный под давлением углекислый газ. Используется в тех случаях, когда нельзя тушить водой (при горении бензина, например)
Итак, мы с вами получили углекислый газ, действуя на гидрокарбонат кислотой
NaHCO3+ CH3COOH = CH3COONa + H2O + CO2
И обнаружили его по его свойствам не поддерживать горение
Но не поддерживать горение может, например и азот.
Как собрать нам прибор, чтобы получить и собрать углекислый газ и пропустить его через известковую воду?
Мы получим углекислый газ в приборе для получения газов из мрамора, действуя кислотой.
Запишите уравнения реакции: СаСО3 + 2НСl=CaCl2 + H2O + CO2↑
А теперь еще раз вернемся к уравнению реакции: CO2 + Ca(OH)2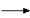 CaCO3
CaCO3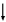 + H2O
+ H2O
К какому классу неорганических соединений относится Ca(OH)2?
(К основаниям) Если оксид взаимодействует с основаниями, значит, он будет по характеру кислотным оксидом.
А как можно еще доказать, что СО2 – кислотный оксид?
Еще какое свойство знаете? ( он растворим в воде и при растворении образуется угольная кислота) так делают газированные напитки.
Возьмите склянки с надписью вода. Представьте, что мы будем сюда пропускать углекислый газ. Чтобы обнаружить кислоту – добавить индикатор лакмус фиолетовый
Лакмус при образовании кислоты станет красным. Кислота слабая, поэтому нельзя ожидать насыщенный красный цвет. Учимся наблюдать самые незначительные изменения цвета.
И еще склянки с известковой водой. Как только заметите изменения цвета опускайте в склянку с известковой водой и продолжайте пропускать до конца реакции. Наблюдайте за происходящими процессами.
III. Практический этап
Выполнение опытов
1.по получению углекислого газа из мрамора
2. пропускание через воду
3. пропускание через известковую воду
Обсуждение результатов
Запись уравнений реакций
H2O + CO2 = H2CO3
CO2 + Ca(OH)2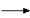 CaCO3
CaCO3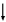 + H2O
+ H2O
СаСО3 + H2O + CO2 = Ca(HCO3)2
Почему при пропускании газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется? ( у кого не произошло растворение взвеси еще добавьте кусочек мрамора)
Наблюдаем переход нерастворимого карбоната кальция в растворимый гидрокарбонат кальция
4. превращение гидрокарбонатов в карбонаты
Итак, у вас в растворе гидрокарбонат кальция. Перенесите его в чистую пробирку.
Как вы думаете, что произойдет при нагревании?
Ca(HCO3)2= СаСО3 ↓+ H2O + CO2 (при нагревании)
Вода содержит гидрокарбонаты кальция. Их содержание определяет жесткость воды. Видели накипь в чайниках? Это и есть образовавшиеся карбонаты при кипячении воды.
А как убрать эту накипь? Прокипятить с лимонной кислотой?
Обсуждение результатов
Мы выполнили с вами удивительное превращение:
CO2 + Ca(OH)2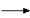 CaCO3
CaCO3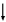 + H2O (1)
+ H2O (1)
СаСО3 + H2O + CO2 = Ca(HCO3)2 (2)
Ca(HCO3)2= СаСО3 ↓+ H2O + CO2 (3)
Получили нерастворимый карбонат –перевели его в растворимый гидрокарбонат- а затем опять в нерастворимый карбонат.
Слайд 8 В природе также протекают такие реакции с участием углекислого газа при образовании мраморных пещер:
углекислый газ извлекается из воздуха дождевой водой; (1)
потоки дождевой воды попадают на пласты известняка и превращают его в растворимый гидрокарбонат кальция, который уносится подземными водами; (2)
в недрах Земли грунтовые воды могут подвергаться нагреванию раствор Ca(HCO3 )2 начинает испаряться, а сама соль разлагается с образованием кристаллов нерастворимого карбоната кальция CaCO3 (3)
Так природа создает сталактиты и сталагмиты, похожие на колонны сказочных дворцов.
5. Распознавание карбонатов
Задача. В химическую лабораторию поступили склянки с растворами солей: карбоната натрия, хлорида натрия, сульфата натрия. Но, к сожалению, на склянках отсутствуют этикетки с названиями и формулами веществ. Определите, в какой из склянок находятся эти вещества. (при недостатке времени в какой из склянок находится карбонат?)
Анализ условия задачи:
Найдите в лоточках склянки с номерами 1,2,3. Задача: определить в какой из склянок находятся соли
Составляем план решения
Сравните по составу соли (имеют одинаковые катионы, отличаются анионами, значит будем определять по анионам). Вспомните качественные реакции на хлорид, сульфат-ионы
Работаем с таблицей.
| Вещества | Какие ионы присутствуют в растворе | Реактив для обнаружения иона и предполагаемый результат | Уравнения реакций |
| HСl | AgNO3 | BaCl2 |
| Nа 2 CО3 | Na+ , CO32- | CO2↑ |
|
| Nа 2 CО3+ 2HСl = 2NаСl + H2O + CO2↑ CО32-+ 2H+ = H2O + CO2↑
|
| NаСl | Na+, Cl- | - | AgCl↓ белый осадок |
| NаСl + AgNO3 = AgCl↓ + NaNO3 Сl- + Ag+ = AgCl↓ белый осадок
|
| Na2SO4 | 2Na+ , SO42- | - |
| Ba SO4 ↓ Белый осадок | Na2SO4 + BaCl2= Ba SO4 ↓+ NаСl SO4 2- + Ba2+ = Ba SO4 ↓ Белый осадок
|
Практическое выполнение: подумайте какие нужны реактивы?
Возможно ли сразу в склянки приливать реактив? (Нет. Нужно взять пробы.)
Из первой склянки – в пробирку №1
Из второй склянки – в пробирку № 2
Из третьей склянки – в пробирку №3
И во все три пробирки приливаем соляную кислоту.
Опять берем пробы и вновь добавляем нитрат серебра
В последнюю пробу добавляем хлорид бария
Обсуждение результатов. Выводы
Закрепление. Тестирование. Слайд 9
IV. Выводы по уроку.
Итак, мы сегодня на уроке, получали углекислый газ, действуя, кислотами на карбонаты и гидрокарбонаты и экспериментальным путем подтвердили наши теоретические знания о свойствах этого газа. Мы еще раз убедились, что это газ, тяжелее воздуха, не поддерживает горения, растворимый в воде. Является кислотным оксидом: реагирует со щелочами и при растворении в воде образует угольную кислоту. А также выполнили удивительные взаимопревращения карбонатов и гидрокарбонатов. И, конечно научились распознавать эти соли.
V.Рефлексия
VI. Задание на дом. Оценивание
Домашнее задание. Как очистить яйцо от скорлупы, не разбивая её? Выполнить домашний эксперимент.
ОФОРМЛЕНИЕ РАБОТЫ
| № | Что делали | Что наблюдали | Уравнения реакций в молекулярном виде | Выводы |
Тест
Получение углекислого газа и изучение его свойств.
1.Элементы C, Si, Ge, Sn, Pb находятся в периодической системе
А) VI Б подгруппа В) IV А подгруппа
Б) VI А подгруппа Г) IIБ подгруппа
2.Верны ли следующие суждения о безопасной работе в химической лаборатории?
А.При растворении серной кислоты в воде, воду приливают в кислоту.
Б. Качественный анализ электролитов проводят по содержащимся ионам
А) верно только А В)верны оба утверждения
Б) верно только Б Г) оба утверждения не верны
3. Оксид углерода(IV) при обычных условиях
А) бесцветная жидкость В)легче воздуха
Б) твёрдое вещество голубого цвета Г)тяжелее воздуха
4.Качественный состав карбонатов можно определить реактивом:
А)нитрата серебра В)гидроксида натрия
Б) соляной кислота Г)хлорида бария
5. При пропускании углекислого газа через раствор известковой воды происходит
А) покраснение раствора В) помутнение раствора
Б) ничего не происходит Г) посинение раствора
Отчет
По результатам практической работы заполните таблицу:
| Номер опыта | Что делали | Что наблюдали | Вывод |
| 1 |
|
|
|
| Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
|
| 2 |
|
|
|
| Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
|
| 3 |
|
|
|
| Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
|
Задача. В химическую лабораторию поступили склянки с растворами солей: карбоната натрия, хлорида натрия, сульфата натрия. Но, к сожалению, на склянках отсутствуют этикетки с названиями и формулами веществ. Определите, в какой из склянок находятся эти вещества.
План распознавания веществ
| Вещества | Какие ионы присутствуют в растворе | Реактив для обнаружения иона и предполагаемый результат | Уравнения реакций |
|
|
|
|
| Nа 2 CО3 | Na+ , CO32- |
|
|
| CО32-+ 2H+ = H2O + CO2↑ Составить молекулярное уравнение |
| NаСl | Na+, Cl- |
|
|
| Сl- + Ag+ = AgCl↓ белый осадок Составить молекулярное уравнение |
| Na2SO4 | 2Na+ , SO42- |
|
|
| SO4 2- + Ba2+ = Ba SO4 ↓ Белый осадок Составить молекулярное уравнение |

















