Практическая работа № 1
«Обнаружение углерода и водорода в органическом соединении.
Цель:
научить определять углерод, водород в органических соединениях;
познакомить с качественными реакциями непредельных углеводородов.
Реактивы: парафин, оксид меди (II), сульфат меди (II), известковая или баритовая вода, медная проволока, хлороформ, гексан, гексен-1, 5%-й спиртовой раствор фенилацетилена, толуол, раствор перманганата калия, карбонат натрия, бромная вода, аммиачный раствор хлорида меди (I).
Посуда и оборудование: лабораторный штатив, штатив для пробирок, пробирки, пробка с газоотводной трубкой, спиртовка, спички.
Обнаружение углерода и водорода
Присутствие углерода в органических соединениях в большинстве случаев можно обнаружить по обугливанию вещества при осторожном его прокаливании.
Наиболее точным методом открытия углерода и одновременно с ним водорода является сожжение органического вещества в смеси с мелким порошком оксида меди. Углерод образует с кислородом оксида меди(П) углекислый газ, а водород — воду. Оксид меди восстанавливается до металлической меди, например:
С13Н28 + 40СuО — 13С02 + 14Н20 + 40Сu
Ход работы
Опыт № 1 Определение углерода и водорода в органическом соединении (парафин)
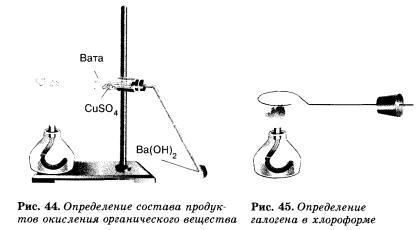
Соберите прибор, как показано на рисунке 44. Смесь 1—2 г оксида меди(II) и -0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди(II). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди(II). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди(II). Нижний конец газоотводной трубки должен быть погружен в пробирку с баритовой водой (раствор гидроксида бария) или известковой водой (раствор гидроксида кальция). Нагрейте пробирку в пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только баритовая вода помутнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(ІІ) и не вызовут его посинения.
После изменения окраски сульфата меди(ІІ) следует прекратить нагревание.
Почему помутнел раствор баритовой воды? Напишите уравнение реакции.
Почему белый порошок сульфата меди(ІІ) стал голубым? Напишите уравнение реакции.
Заполнить таблицу
| №п/п | Исходные вещества | Наблюдение | Уравнение реакций | Вывод |
| Название | Формула |
|
|
|
|
|
|
Выводы:
обнаружив образовавшиеся в результате реакции углекислый газ и воду, вы установили в исследованном веществе наличие углерода и водорода. Так как эти элементы не содержались в добавленном оксиде меди(ІІ), то они могли находиться только во взятом для анализа органическом веществе.
Практическая работа № 2
«Обнаружение галогенов (проба Бейльштейна)»
Цель:
Реактивы: медная проволока, хлороформ, оксид меди (II)
Посуда и оборудование: лабораторный штатив, штатив для пробирок, пробирки, пробка с газоотводной трубкой, спиртовка, спички.
Ход работы
Опыт № 1 Обнаружение галогенов (проба Бейльштейна)
Галогены можно обнаружить при помощи реакции окрашивания пламени, предложенную русским химиком Ф. Ф. Бейльштейном.
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в небольшую пробку (рис. 45).

Держа за пробку, прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (ІІ), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Выводы:
обнаружив образовавшиеся в результате реакции углекислый газ и воду, вы установили в исследованном веществе наличие углерода и водорода. Так как эти элементы не содержались в добавленном оксиде меди(ІІ), то они могли находиться только во взятом для анализа органическом веществе.
Практическая работа № 3
«Получение метана и изучение его свойств: горения, отношения к бромной воде и раствору перманганата калия»
Зафиксируйте в тетради каждый опыт по алгоритму:
записать название опыта;
открыть по ссылке электронный ресурс;
ознакомиться с описанием опыта, кратко записать ход опыта и уравнение реакции;
просмотреть видеоролик, записать признаки реакции;
сделать вывод о реакционной способности вещества или о способах получения.
Опыт 1. Получение метана
http://files.school-collection.edu.ru/dlrstore/ceac7808-399a-9ac6-db56-7ed204f861fa/index.htm
Опыт 2. Горение метана
http://files.school-collection.edu.ru/dlrstore/5e8f612a-b762-9f6b-de63-c5dc1d3e64c5/index.htm
Опыт 3. Отношение метана к раствору перманганата калия и бромной воде http://files.school-collection.edu.ru/dlrstore/73ccda2d-12a7-ccd3-233c-1ec5450c05f0/index.htm
Сделайте вывод о химической активности алканов - предельных углеводородов.
Ответьте на вопросы:
Какие реакции являются качественными реакциями на непредельные углеводороды.
Практическая работа № 4
«Получение этилена дегидратацией этилового спирта.
Цель работы: научиться получать этилен в лаборатории и проводить качественные реакции на непредельные углеводороды этиленового ряда.
Запишите в тетради тему практической работы. Затем последовательно зафиксируйте в тетради каждый опыт по алгоритму:
записать название опыта;
открыть по ссылке электронный ресурс;
ознакомиться с описанием опыта, кратко записать ход опыта и уравнение реакции;
просмотреть видеоролик, записать признаки реакции;
сделать вывод о реакционной способности вещества или о способах получения.
Опыт 1. Поучение этилена из этилового спирта
http://files.school-collection.edu.ru/dlrstore/e659f378-5a0f-07e2-5491-fe1ca9d05442/index.htm
Практическая работа № 5
«Взаимодействие этилена с бромной водой, раствором перманганата калия.»
Цель работы: научиться проводить качественные реакции на непредельные углеводороды этиленового ряда.
Запишите в тетради тему практической работы. Затем последовательно зафиксируйте в тетради каждый опыт по алгоритму:
записать название опыта;
открыть по ссылке электронный ресурс;
ознакомиться с описанием опыта, кратко записать ход опыта и уравнение реакции;
просмотреть видеоролик, записать признаки реакции;
сделать вывод о реакционной способности вещества или о способах получения.
Опыт 1. Взаимодействие этилена с бромной водой
http://files.school-collection.edu.ru/dlrstore/e920f54f-3088-7973-829d-909ad427fbc8/index.htm
Опыт 2. Взаимодействие этилена с раствором перманганата калия
http://files.school-collection.edu.ru/dlrstore/a2fde3eb-37b0-b327-af25-099e3fa00573/index.htm
Сделайте вывод о реакционной способности алкенов.
Вывод:
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
Практическая работа № 6
«Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси)»
Цель работы: научиться сравнивать реакции горения предельных и непредельных углеводородов этиленового ряда.
Запишите в тетради тему практической работы. Затем последовательно зафиксируйте в тетради каждый опыт по алгоритму:
записать название опыта;
открыть по ссылке электронный ресурс;
ознакомиться с описанием опыта, кратко записать ход опыта и уравнение реакции;
просмотреть видеоролик, записать признаки реакции;
сделать вывод о реакционной способности вещества или о способах получения.
Опыт 1. Горение этилена
http://files.school-collection.edu.ru/dlrstore/80d12abd-df02-dd41-7770-f1cd1f794ccf/index.htm
Ответьте на вопросы:
Что общее и в чем отличие химических свойств метана (алкан) и этилена (алкен)?
Задание:
Смесь этана и этилена объёмом 0,8 л (н.у.) обесцветила 200 г бромной воды с массовой долей 1,6%. Определите объёмную долю каждого газа в смеси.
Вывод: В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода.
Практическая работа № 7
«Изучение растворимости спиртов в воде.»
Цель: Изучить растворимость спиртов в воде.
Ход работы
Опыт № 1 Растворимость спиртов в воде
В отдельные пробирки прилейте по 1—2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой.
Вопросы к опыту:
1. В чем причина различного «поведения» спиртов в воде?
2. Почему изоамиловый спирт отслаивается над водой, а не наоборот?
3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
Практическая работа № 8
«Окисление спиртов различного строения хромовой смесью.»
Цель: Провести реакции окисления спиртов различного строения хромовой смесью.
Ход работы
Опыт № 1 Окисление этилового спирта хромовой смесью
В пробирке смешайте 2 мл 5% -ного раствора дихромата калия, 1 мл 20%-ного раствора серной кислоты и 0,5 мл этилового спирта. Отметьте цвет раствора. Осторожно нагрейте смесь на пламени горелки до начала изменения цвета. При этом ощущается характерный запах уксусного альдегида, образующегося в результате реакции.
Вопросы к опыту:
1. Почему цвет раствора меняется с оранжевого до синевато-зеленого? Напишите уравнение реакции окисления этилового спирта.
2. Можно ли заменить серную кислоту в данной реакции на соляную?
Практическая работа № 9
«Получение диэтилового эфира.»
Цель: Провести реакцию получения диэтилового эфира.
Ход работы
Опыт № 1 Получение диэтилового эфира
Соберите прибор, как показано на рис. 10. В пробирку А налейте 2 мл смеси этилового спирта и серной кислот и для равномерного кипения жидкости добавьте немного тертого кирпича. Пробирку А с помощью пробки с газоотводной трубкой присоедините к пробирке Б. В пробирку Б налейте 2‑3 мл насыщенного раствора хлорида натрия. Пробирку Б поместите в химический стакан с холодной водой и кусочками льда. Отверстие пробирки закройте ватным тампоном.
Реакционную смесь нагревайте в пробирке на слабом пламени спиртовки. При этом можно заметить, что в пробирке Б образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон. Ощущается ли запах эфира?
Задания: 1. Зарисуйте прибор, указав содержимое пробирок А и Б.
2. Напишите уравнение протекающей реакции, отметьте наблюдения.
3. Какова роль серной кислоты в реакции этерификации?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 10
«Получение глицерата меди»
Цель: Провести реакции получения глицерата меди.
Ход работы
Опыт № 1 Получение глицерата меди
В пробирку налейте около 1 мл 10% -ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II).
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
Вопросы к опыту:
1. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции.
2. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).
3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Практическая работа № 11
«Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди (II). Взаимодействие формальдегида с гидросульфитом натрия»
Цель работы: закрепить знания о свойствах альдегидов и с помощью качественных реакций распознавать альдегиды среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!










Ход работы:
Опыт №1. Реакция «серебряного зеркала».
Оборудование: штатив с пробирками, спиртовка, спички.
Реактивы: 10%-ный раствор NaOH , CuSO4, NH4OH AgNO3,формалин.
В пробирку налейте 2 мл раствора формалина и добавьте несколько капель аммиачного раствора нитрата серебра.
Пробирку нагрейте до появления серебра на стенках пробирки.
Запишите уравнение реакции.
Опыт № 2.Взаимодействие этаналя с гидроксидом меди (II).
Оборудование: штатив с пробирками, спиртовка, спички.
Реактивы: 10%-ный раствор NaOH , CuSO4, этаналь.
1.Налейте в пробирку 1 мл раствора этаналя и столько же раствора гидроксида натрия.
2. Затем добавьте несколько капель раствора сульфата меди (II). Пробирку с полученным раствором нагрейте. Что наблюдаете?
3.Напишите уравнение реакции между сульфатом меди (II) и гидроксидом натрия. Напишите уравнение реакции взаимодействия этаналя с полученным раствором гидроксидом меди (II).
Вывод: Как обнаружить альдегиды?
Запишите общий вывод по работе.
Практическая работа № 12
«Взаимодействие формальдегида с гидросульфитом натрия»
Цель работы: закрепить знания о свойствах альдегидов и с помощью качественных реакций распознавать альдегиды среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!











Ход работы:
Опыт №1. Окисление бензальдегида кислородом воздуха.
Оборудование: часовое или предметное стекло.
Реактивы: 10%-ный раствор бензойного альдегида.
1.На предметное стекло поместите 2 капли бензальдегида и оставьте на 30 минут. Наблюдайте образование белых кристаллов по краям капли. Происходит реакция окисления альдегида и образуется бензойная кислота. Запишите уравнение реакции.
Вывод: До каких продуктов окисляются альдегиды?
Опыт № 2. Получение ацетона из ацетата натрия.
Оборудование: штатив с пробирками, спиртовка, спички.
Реактивы: крист.ацетат натрия- СН3СООNa, конц. раствор HCI, Н2О.
1.В пробирку поместите порошок ацетата натрия и укрепите в лабораторном штативе. Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в пробирку с водой.
2.Пробирку с ацетатом натрия нагрейте на спиртовке и наблюдайте выделение газа в пробирке с водой. Чувствуется своеобразный запах ацетона.
3.После нагревания в пробирку, где был ацетат натрия, прилейте две – три капли конц. раствора HCI. Наблюдайте выделение газообразного вещества. Определите этот газ. Запишите уравнения реакций.
Вывод: Как можно в лаборатории получить ацетон?
Запишите общий вывод по работе.
Практическая работа № 13
«Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами.»
Цель работы:
Получить уксусную кислоту и изучить её свойства; закрепить знания о карбоновых кислотах,
Реактивы и оборудование:
ацетат натрия, серная кислота (конц.), магний (порошок), цинк, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, гидроксид натрия, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; концентрированная серная кислота,
конические колбы с пробками, мерные цилиндры, пробирки, разбавленные растворы соляной или серной кислот,
металлический штатив, спиртовка, газоотводная трубка с пробкой, пробирки, химический стакан, ватный тампон, тертый кирпич;
Ход работы
Напишите возможные изомеры для соединений с формулой С5Н10О2
С какими из перечисленных веществ будет реагировать уксусная кислота: оксид магния, гидроксид алюминия, сульфат бария, карбонат калия, формиат натрия, цинк? Запишите уравнения возможных реакций.
Как осуществить превращения: этан – этилен – ацетилен – ацетальдегид – уксусная кислота – метиловый эфир уксусной кислоты.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 14
«Получение изоамилового эфира уксусной кислоты.»
Цель работы:
1. Закрепить знания о карбоновых кислотах,
Получить изоамиловый эфир уксусной кислоты, исследовать его физические свойства.
Реактивы и оборудование:
1. уксусная кислота, спиртовка, пробирку, вата, спички, изоамиловый спирт.
2.спиртовка, колба с обратным холодильником, стеклянная палочка, химические стаканы; изоамиловый спирт, концентрированная уксусная кислота, концентрированная серная кислота
3.конические колбы с пробками, мерные цилиндры,
4.металлический штатив, спиртовка, газоотводная трубка с пробкой, пробирки, химический стакан, ватный тампон, тертый кирпич;
Ход работы
Запишите уравнение этерификации пропанола и масляной кислоты.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение изоамилового эфира уксусной кислоты, исследование его физических свойств.
Соберите прибор, как показано на рис. 10. В пробирку А налейте 2 мл смеси изоамилового спирта, уксусной и серной кислот и для равномерного кипения жидкости добавьте немного тертого кирпича. Пробирку А с помощью пробки с газоотводной трубкой присоедините к пробирке Б. В пробирку Б налейте 2‑3 мл насыщенного раствора хлорида натрия. Пробирку Б поместите в химический стакан с холодной водой и кусочками льда. Отверстие пробирки закройте ватным тампоном.
Реакционную смесь нагревайте в пробирке на слабом пламени спиртовки. При этом можно заметить, что в пробирке Б образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон. Ощущается ли запах эфира?
Задания: 1. Зарисуйте прибор, указав содержимое пробирок А и Б.
2. Напишите уравнение протекающей реакции, отметьте наблюдения.
3. Какова роль серной кислоты в реакции этерификации?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 15
«Сравнение степени ненасыщенности твердого и жидкого жиров.»
Цель работы:
1.Изучить некоторые физические и химические свойства жиров.
2.Получить сложные жиры карбоновых кислот и исследовать их физические свойства.
Реактивы и оборудование:
1. спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; твердый жир, 15 % спиртовой раствор щелочи, этиловый спирт, концентрированная уксусная кислота, концентрированная серная кислота, раствор растительного масла (2 капли масла на 1 мл гексана или очищенного керосина), бромная вода, насыщенный раствор поваренной соли, 5 % раствор соды, раствор мыла, раствор белка, бензин, толуол, 5 % раствор КОН, 5 % раствор Na2CO3.
2.конические колбы с пробками, мерные цилиндры, навески мыла и синтетического моющего средства, пробирки, разбавленные растворы соляной или серной кислот, раствор гидроксида натрия или калия, раствор ацетата свинца, сульфат меди (II), фенолфталеин, жесткая вода.
Ход работы
1.Напишите уравнение получения триглицерида, если в его состав входят остатки пальмитиновой, стеариновой и олеиновой кислот.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение сложных жиров карбоновых кислот.
В пробирку налейте 1 мл этилового спирта, 1 мл концентрированной уксусной кислоты и 0,5-1 мл концентрированной серной кислоты. Смесь в пробирке осторожно перемешайте и нагрейте на водяной бане, не доводя до кипения. Окончание реакции определите по появлению запаха сложного эфира, отличного от запаха карбоновой кислоты и спирта, взятых для синтеза. Дайте жидкости остыть и вылейте ее в стаканчик с насыщенным раствором поваренной соли. Какой ощущается запах? Где собирается эфир? Какова его растворимость? Какую консистенцию он имеет? Для чего используется кислота в процессе синтеза сложного эфира?
Задания:
1. Составьте в структурном виде уравнение реакции получения сложного эфира, укажите условия ее протекания.
2. Опишите физические свойства полученного эфира, ответьте на вопросы, поставленные в тексте эксперимента.
Опыт 2. Физические свойства жиров.
а) Растворимость жиров в различных растворителях.
В 4 пробирки поместите 1-2 капли растительного масла. Прилейте в первую пробирку 1 мл этилового спирта, во вторую – 1 мл бензина, в третью – 1 мл воды, в четвертую – 1 мл толуола.
Взболтайте содержимое пробирок и дайте постоять. В каждой ли пробирке растворился жир? Какие вещества являются хорошими растворителями жиров, а какие – плохими? Почему?
Задания:
1. Результаты эксперимента оформите в виде таблицы.
2. Сделайте вывод о растворимости жиров на основании опыта.
б) Эмульгирование жиров.
Если жиры хорошо взболтать с водой, то они образуют эмульсию, т.е. систему, в которой мелкие капельки жира взвешены в воде. Эмульсия масла в воде быстро разрушается, т.к. капельки жира, сталкиваясь друг с другом, образуют крупные капли, создающие слой жира на поверхности воды. Есть вещества, которые, адсорбируясь на поверхности капель, не дают соединиться каплям жира в более крупные, т.е. повышают устойчивость эмульсии – эмульгаторы.
В 5 пробирок налейте по 3-4 капли растительного масла. Добавьте в первую пробирку 5 мл воды, во вторую – 5 мл 5 % раствора КОН, в третью – 5 мл 5 % раствора соды, в четвертую – 5 мл раствора мыла, в пятую – 5 мл раствора белка. Сильно встряхните содержимое каждой пробирки и наблюдайте образование эмульсии.
Задания:
1. Результаты эксперимента оформите в виде таблицы.
2. Сделайте вывод об эмульгирующих свойствах различных веществ.
Опыт 3. Выделение жирных кислот.
а) Рассчитайте необходимый объем дистиллированной воды для приготовления 1 % растворов из выданных навесок мыла и синтетического моющего средства (СМС). Приготовьте растворы.
б) Налейте в пробирку 1 мл приготовленного раствора мыла и прибавьте разбавленной соляной или серной кислоты до образования хлопьев. Что собой представляет этот осадок? Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
Задания:
1. Составьте уравнения соответствующих реакций, запишите наблюдения.
2. Ответьте на вопросы, поставленные в тексте эксперимента.
Опыт 4. Получение нерастворимых солей жирных кислот.
В две пробирки налейте по 1 мл мыльного раствора, добавьте в них соответственно растворы ацетата свинца Pb(CH3COO)2 и сульфата меди (II) CuSO4.
Задание: Объясните изменения, происходящие в каждой пробирке, запишите уравнения соответствующих реакций и наблюдения.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 16
«Омыление жира.»
Цель работы:
1.Закрепить знания о сложных эфирах и жирах.
2.Изучить некоторые физические и химические свойства жиров.
3.Получить сложные жиры карбоновых кислот и исследовать их физические свойства.
Реактивы и оборудование:
1.спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; твердый жир, 15 % спиртовой раствор щелочи
2.конические колбы с пробками, мерные цилиндры, пробирки, разбавленные растворы соляной или серной кислот, раствор гидроксида натрия или калия,
Ход работы
1.Что такое мыло и какая реакция лежит в основе его производства? Напишите уравнение реакции.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 6. Омыление жиров в водно-спиртовом растворе.
Соберите прибор, как показано на рис. 9. В круглодонную колбу вместимостью 20 мл поместите 3-4 г измельченного твердого жира и налейте 8 мл 15 % спиртового раствора NaOH.
Перемешайте смесь стеклянной палочкой, колбу со смесью закройте обратным холодильником, опустите в водяную баню, закрепив в лапке штатива, нагрейте в течение 15-20 минут. Омыление жира следует проводить до тех пор, пока содержимое колбы не станет однородным. Оно обычно заканчивается образованием плотной твердой пленки на дне колбы. Затем колбу извлеките из водяной бани, дайте ей остыть, и добавьте в нее воды, хорошо взболтайте. Сравните растворимость полученного вещества с растворимостью жира, из которого оно было получено.
Задания:
1. Составьте уравнение реакции щелочного омыления твердого тристеарина, укажите условия ее протекания и наблюдения.
2. Как доказать, что продуктом данной реакции является мыло?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 17
«Получение мыла и изучение его свойств: пенообразования, реакций ионного обмена, гидролиза, выделения свободных жирных кислот»
Цель работы:
1.Сравнить свойства мыла и синтетических моющих средств.
Реактивы и оборудование:
1.спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; твердый жир, 15 % спиртовой раствор щелочи, насыщенный раствор поваренной соли, 5 % раствор соды, раствор мыла, раствор белка, бензин, толуол, 5 % раствор КОН, 5 % раствор Na2CO3.
2.конические колбы с пробками, мерные цилиндры, навески мыла и синтетического моющего средства, пробирки, разбавленные растворы соляной или серной кислот, раствор гидроксида натрия или калия, раствор ацетата свинца, сульфат меди (II), фенолфталеин, жесткая вода.
Ход работы
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Сравнение свойств мыла и синтетических моющих средств.
а) Влейте по 2-3 мл растворов мыла и СМС в пробирки, добавьте к ним 2‑3 капли раствора фенолфталеина. Каков цвет раствора? Почему?
Задания:
1. Напишите уравнение реакции гидролиза мыла, запишите наблюдения.
2. Ответьте на вопросы, поставленные в тексте эксперимента.
б) В 2 пробирки влейте по 4-5 мл жесткой воды, содержащей ионы Са2+ и Mg2+. В первую пробирку при встряхивании добавьте раствор мыла, во вторую – раствор синтетического моющего средства. В каком случае приходится прибавлять больше раствора до образования устойчивой пены? Какой препарат не утрачивает моющего действия в жесткой воде? Почему?
Задания:
1. Напишите уравнение реакции, происходящей в растворе мыла.
2. Запишите наблюдения явлений, происходящих в обеих пробирках, объясните их причину.
На основании проделанных опытов сделайте вывод о преимуществах и недостатках мыла и СМС.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 11
«Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах.»
Цель работы: Исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Оборудование и реактивы: металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, лактозы, фруктозы; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Ход работы:
ОПЫТ 1. Свойства глюкозы.
Внесите в пробирку 3 капли раствора глюкозы, одну каплю раствора соли меди и прибавьте при взбалтывании несколько капель гидроксида натрия до образования светло-синего раствора (щелочь должна быть в избытке). Что доказывает появление такой окраски раствора? Вспомните реакцию образования глицерата меди.
Полученный раствор нагрейте. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Задания:
1. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при комнатной температуре. Укажите наблюдения. На наличие каких функциональных групп указывает эта реакция?
2. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при нагревании. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
ОПЫТ 2. Взаимодействие сахаров с гидроксидом меди (II).
Опыт проводят одновременно с растворами различных сахаров.
К 2 мл раствора сахара добавьте 1 мл разбавленного раствора щелочи и 3‑4 капли раствора сульфата меди (II). Встряхните пробирку и перемешайте содержимое пробирки стеклянной палочкой до растворения осадка. Жидкость при этом окрашивается в интенсивно-синий цвет.
Затем поместите все пробирки в нагретую водяную баню. Если сахар окисляется, то, вынув пробирку через 2-3 минуты, вы увидите изменения окраски и появление красного или коричневого осадка.
Задание: Заполните следующие таблицы:
Результаты опыта, проведенного при нормальных условиях
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
ОПЫТ 3. Взаимодействие сахаров с аммиачным раствором оксида серебра (I).
Опыт проводят одновременно с растворами различных сахаров.
Налейте в тщательно вымытые и высушенные пробирки по 1 мл аммиачного раствора оксида серебра (I) и по 1 мл раствора сахара. Пробирки поместите на несколько минут в горячую водяную баню.
Задание: Заполните следующую таблицу:
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
Запишите уравнение соответствующей реакции для глюкозы.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 19
« Обнаружение лактозы в молоке.»
Цель работы: Исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Оборудование и реактивы: металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, лактозы, фруктозы; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Ход работы:
ОПЫТ № 1: Обнаружение лактозы в молоке.
В молоке дисахарид лактозу обнаруживают реакцией Фелинга, содержащего комплексно связанные с виннокислой кислотой ионы Cu2+. В результате реакции образуется оксид меди (I), выделяющийся в виде красного осадка Cu2O.
Предварительно осаждают белки молока добавлением трихлоруксусной кислоты (ТХУ) и фильтруют. К 10 каплям фильтрата добавляют 10 капель дистиллированной воды, 10 капель NaOH и 6 капель реактива Фелинга. Смесь нагревают. Отмечают характер появляющегося окрашивания.
Задание: Запишите все происходящие наблюдения. Оформите наблюдения в виде схемы.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 20
«Образование солей анилина. Бромирование анилина.»
Цель работы:
1. Изучить химические свойства анилина.
2. Выполнить и запомнить качественные реакции на анилин.
Оборудование и реактивы: спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
ХОД РАБОТЫ
ОПЫТ 1. Образование солей анилина
В пробирку налейте 0,5 мл анилина и 3 мл дистиллированной воды. Взболтайте. Что наблюдаете? В пробирку добавьте соляной кислоты до полного растворения анилина в воде. Добавьте в пробирку 1—2 мл раствора щёлочи. Что наблюдаете?
Вопросы
1. Почему при добавлении соляной кислоты происходит растворение анилина? Напишите соответствующее уравнение реакции.
2. Почему при добавлении щёлочи анилин выделяется из водного раствора? Напишите уравнение реакции.
ОПЫТ 8. Бромирование анилина
В пробирку налейте 0,5 мл анилина и 0,5 мл дистиллированной воды. Прибавьте по каплям бромной воды до появления осадка.
Задания:
1. Почему обесцвечивается бромная вода?
2. Каково строение образующегося осадка? Напишите уравнение реакции.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 21
«Образование солей глицина. Получение медной соли глицина.»
Цель работы:
1. Изучить образование солей глицина.
Оборудование и реактивы: спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
ХОД РАБОТЫ
ОПЫТ 1. Амфотерные свойства аминокислот
В пробирку налейте 2—3 мл раствора карбоната натрия и всыпьте щепотку глицина. Что наблюдаете? Напишите уравнение реакции.
Поместите в пробирку немного кристалликов глицина, смочите их несколькими каплями соляной кислоты и нагрейте. Что наблюдаете? Вылейте несколько капель образовавшегося раствора на часовое стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Напишите уравнение реакции.
Задания:
1. Какие свойства глицина проявляются в каждой из этих реакций?
2. Сравните форму кристаллов глицина и гидрохлорида глицина. Чем они отличаются?
ОПЫТ 2. Получение медной соли глицина
В пробирку, содержащую 2 мл раствора глицина, добавьте 1 г порошка оксида меди (II) и нагрейте до кипения.
Задания:
1. Чем обусловлено появление голубой окраски раствора?
2. Каково строение образующейся соли?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 22
«Денатурация белка. Цветные реакции белков»
Цель работы:
1. Изучить химические свойства белков.
2. Выполнить и запомнить качественные реакции на белки.
Оборудование и реактивы: спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
ХОД РАБОТЫ
ОПЫТ 1. Свертывание белков при нагревании.
2-3 мл раствора белка налейте в пробирку и нагрейте в пламени спиртовки до кипения. Что при этом наблюдается? Чем можно объяснить это явление? Содержимое пробирки разбавьте водой. Растворяется ли осадок, если нет, то почему?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 2. Осаждение белков солями тяжелых металлов.
В две пробирки налейте по 1-2 мл раствора белка и медленно, по каплям, при встряхивании прилейте в одну из них насыщенный раствор сульфата меди (II), а в другую – насыщенный раствор ацетата свинца. Что наблюдается? Затем содержимое пробирок разбавьте большим количеством воды. Что наблюдается при этом?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод о действии солей тяжелых металлов на белок.
ОПЫТ 3. Осаждение белков минеральными кислотами.
Налейте в одну пробирку 1 мл концентрированной азотной кислоты, в другую – 1 мл концентрированной соляной кислоты, в третью – 1 мл концентрированной серной кислоты. Каждую пробирку наклоните и осторожно влейте в нее по стенке 1-1,5 мл раствора белка так, чтобы он не смешивался с более тяжелым слоем кислоты, затем пробирку поставьте в штатив. Что наблюдается на границе раздела двух жидкостей?
Затем пробирки встряхните. Какие изменения происходят при этом в пробирках?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод об отношении белка к концентрированным кислотам.
ОПЫТ 4. Высаливание белков сульфатом аммония.
В пробирку налейте 1-1,5 мл раствора белка, прилейте равный объем насыщенного раствора сульфата аммония. Смесь слегка встряхните. Что наблюдается? Что происходит с белком?
Смесь разбавьте большим количеством воды. Что происходит с осадком? Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 5. Осаждение белков этиловым спиртом.
В пробирку налейте 1-1,5 мл раствора белка, прилейте 2-3 мл этанола. Что наблюдается? Проверьте, растворяется ли осадок в воде. Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 6. Цветные реакции на белки.
а) Ксантопротеиновая реакция.
К 1 мл раствора белка добавьте 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свертывания белка. Реакционную смесь нагрейте до окрашивания осадка в желтый цвет. В процессе гидролиза, происходящем при этом, осадок может частично растворяться. Смесь охладите и добавьте к ней осторожно, по каплям, избыток концентрированного раствора аммиака. Окраска при этом переходит в оранжевую. Данная реакция является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
б) Биуретовая реакция.
В пробирку налейте 1-2 мл раствора белка, равный объем концентрированного раствора щелочи и 2-3 капли разбавленного раствора сульфата меди (II). Содержимое пробирки тщательно перемешайте. Жидкость при этом окрашивается в ярко-фиолетовый цвет. Эта реакция также является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
в) Сульфгидрильная реакция.
В пробирку налейте 0,5 мл раствора ацетата свинца и 2 мл раствора гидроксида натрия до растворения образовавшегося осадка гидроксида свинца (II). В результате получается плюмбит натрия Na2PbO2. В другую пробирку налейте 2 мл белка и прилейте из первой пробирки столько же плюмбита натрия.
Смесь нагрейте до кипения. При нагревании белок гидролизуется, и образуется сероводород, который вступает во взаимодействие с раствором Na2PbO2 с образованием черного или черно-коричневого осадка сульфида свинца PbS.
Задания:
1. Запишите все соответствующие наблюдения.
2. Напишите уравнения реакций образования гидроксида свинца (II) и плюмбита натрия.
3. Что позволяет обнаружить данная реакция в белке?
Все ответы на задания и результаты опытов записать в тетрадь.




























