Практическая работа №1
Приёмы безопасной работы с оборудованием и веществами. Строение пламени.
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание № 1
Приёмы обращения с лабораторным штативом.
А) Ознакомьтесь с устройством штатива по рисунку (рис.1)
. 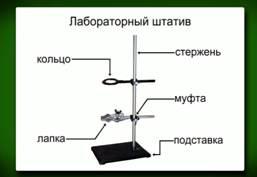 Рис. 1
Рис. 1
Б) Снимите со штатива лапку и кольцо, затем снова закрепите их.
В) Закрепите в лапке пробирку в вертикальном положении отверстием вверх.
Г) На одно кольцо штатива положите сетку, на неё поставьте стакан.
Д) На второе кольцо установите фарфоровую чашку без сетки.
Задание № 2
Приёмы обращения со спиртовкой.
А) Ознакомьтесь с устройством спиртовки по рисунку (рис.2)
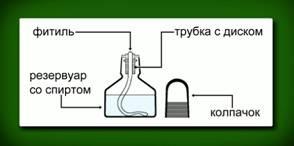 Рис. 2
Рис. 2
Б) Снимите колпачок со спиртовки, проверьте, плотно ли диск прилегает к отверстию резервуара, иначе спирт в нём может загореться.
В) Зажгите спиртовку спичкой (нельзя зажигать её от другой горящей спиртовки!)
Г) Погасите спиртовку, накрыв её колпачком.
Задание № 3
Изучение строения пламени.
А) Зажгите спиртовку и посмотрите, какое строение имеет пламя?
Б) Определите три зоны пламени.
Г) Быстро внесите спичку, сначала, в нижнюю часть пламени, затем среднюю и верхнюю, подержите её некоторое время. Сравните время возгорания спичек в каждой зоне.
Д) Зарисуйте в тетради строение пламени спиртовки и на рисунке обозначьте различные зоны пламени.
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 2
Очистка загрязнённой поваренной соли
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Опыт № 1
Растворение загрязнённой поваренной соли.
1. В стакан с загрязнённой поваренной солью налейте примерно 20 мл воды.
2. Аккуратно перемешайте содержимое стеклянной палочкой.
3. Если соль не растворилась, добавляйте понемногу воды до тех пор, пока соль не раствориться.
Опишите раствор.
Опыт № 2
Очистка раствора при помощи фильтрования
1. Вставьте воронку в стакан (колбу), в котором будет собираться отфильтрованный раствор.
2. Изготовьте фильтр.
3. Раскройте фильтр и положите в воронку.
4. Мутный раствор медленно наливайте на фильтр.
Опишите раствор.
Опыт № 3
Выпаривание раствора
1.Полученный фильтрат вылейте в фарфоровую чашку и поставьте её на кольцо штатива.
2. Нагревайте чашку в пламени горелки, периодически перемешивая фильтрат до полного испарения воды.
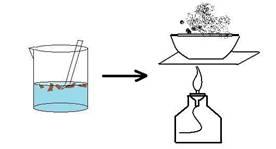
Полученную соль сравните с исходной.
Отчёт о проделанной работе оформите в виде таблицы
| Что делали (названия опытов, рисунки приборов с обозначениями) | Что наблюдали | Выводы |
|
|
|
|
ВЫВОД:
Практическая работа № 3
Получение и свойства кислорода
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Опыт №1
Получение и собирание кислорода.
Соберите прибор, как показано на рисунке. И проверьте его на герметичность.
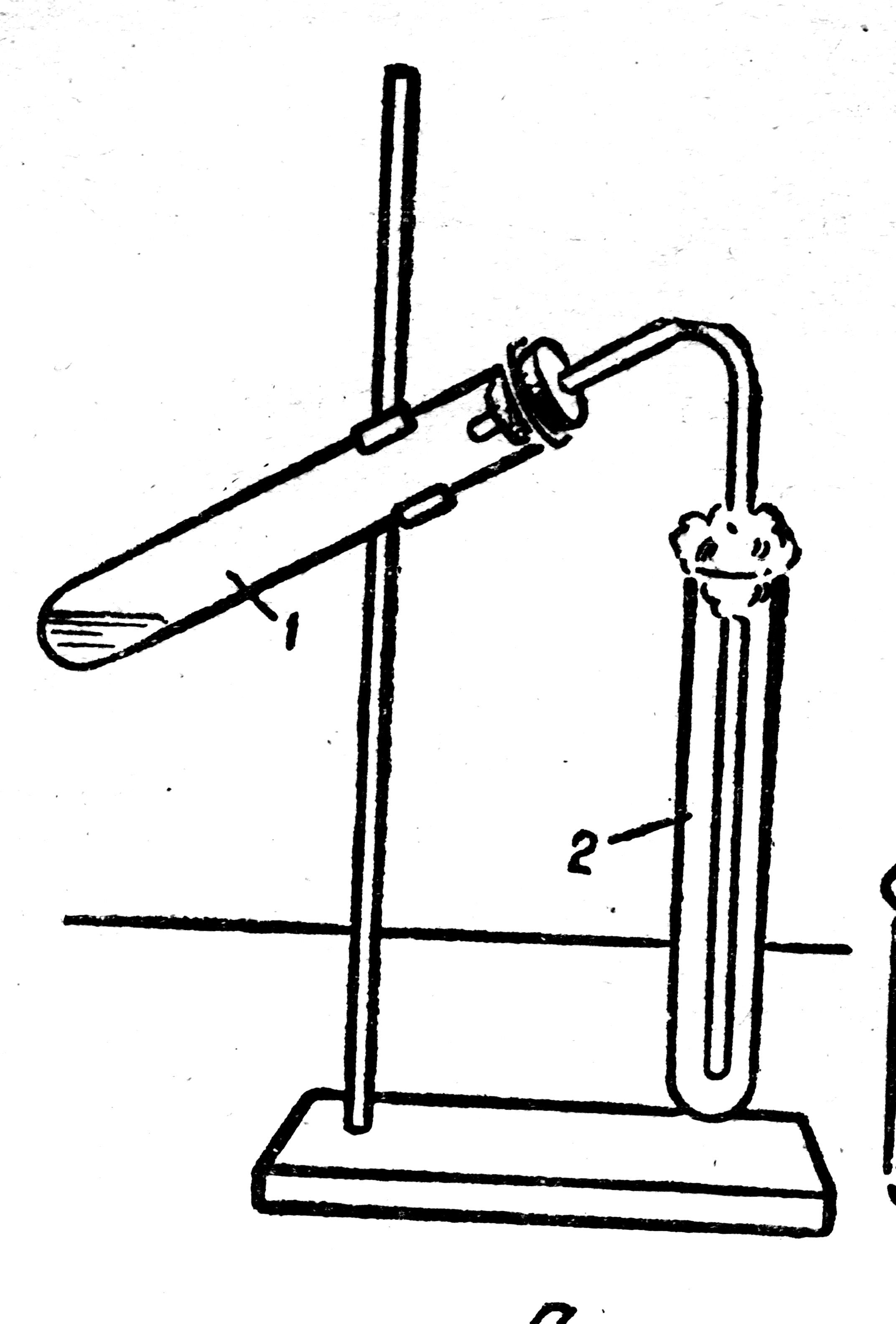
В пробирку насыпьте перманганат калия на 0,125 её объёма, у отверстия пробирки положите рыхлый комочек ваты.
Закройте пробирку пробкой с газоотводной трубкой.
Закрепите пробирку в лапке штатива так, чтобы конец трубки почти доходил до дна пробирки.
В пламени спиртовки нагревайте пробирку (сначала всю пробирку, а затем её дно).
6. Полноту заполнения проверяйте тлеющей лучиной.
Опыт №2
Горение угля в кислороде
Положите в железную ложечку таблетку активированного угля и раскалите его в пламени спиртовки.
Внесите ложечку с тлеющим углём в пробирку с кислородом и наблюдайте за происходящим.
Когда горение прекратится, влейте в сосуд немного известковой воды и взболтайте. Почему раствор помутнел?
Запишите уравнение реакции горения угля.
Отчёт о проделанной работе оформите в виде таблицы
| Что делали (названия опытов, рисунки приборов с обозначениями) | Что наблюдали | Выводы |
|
|
|
|
|
|
|
|
|
|
|
|
ВЫВОД:
Практическая работа № 4
Получение водорода и исследование его свойств
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Опыт №1
Получение и собирание водорода методом вытеснения воды.
Соберите прибор, как показано на рисунке. И проверьте его на герметичность.
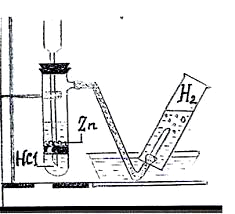
В пробирку поместите несколько гранул цинка и добавьте 2-3 мл разбавленной соляной кислоты.
В течение минуты дайте газу свободно выходить из пробирки, а затем конец газоотводной трубки подведите к горлышку пробирки, предварительно заполненной водой и помещённой в воду в перевёрнутом виде в чашку с водой.
Когда газ заполнит пробирку, закройте её под водой и поставьте в штатив горлышком вниз.
Опыт №2
Получение и собирание водорода методом вытеснения воздуха.
Повторите опыт, взяв вместо соляной кислоты серную. Водород соберите в пробирку, перевернутую вверх дном.
Напишите уравнение реакции цинка: а) с соляной кислотой, б) с серной кислотой.
Опыт №3
Горение водорода
Проверьте собранный вами водород на чистоту. Для этого пробирку, наполненную водородом, поднесите к пламени горелки.
(Горелка должна быть на расстоянии не менее 0,5 м от прибора).
Если вы собрали чистый водород, он сгорает спокойно, с характерным звуком «п-пах». Если водород содержит примесь воздуха, слышен характерный свистящий хлопок.
Отчёт о проделанной работе оформите в виде таблицы
| Что делали (названия опытов, рисунки приборов с обозначениями) | Что наблюдали | Выводы |
|
|
|
|
|
|
|
|
|
|
|
|
ВЫВОД:
Практическая работа № 5
Приготовление раствора с определённой массовой долей растворённого вещества.
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задача 1
А) Вычислите сколько г сахара (С12Н22О11) необходимо и какой объём воды потребуется для приготовления 60 г 4% раствора. Чему равно количество сахара в растворе?
Б) Решите задачу в тетради и приготовьте данный раствор в колбе, используя готовую навеску сахара,
В) Подпишите этикетку по образцу и приклейте её.
Задача 2
А) Приготовьте 50 г 6% раствора NaCl и рассчитайте количество и число молекул данного вещества в растворе.
Б) Решите задачу в тетради и приготовьте данный раствор в колбе, используя готовую навеску, подпишите этикетку по образцу и приклейте её.
Раствор (формула в-ва) ……%
Приготовили: Ф.И.
дата
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 6
Решение экспериментальных задач по теме
«Важнейшие классы неорганических соединений».
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задача 1
| Вариант 1 | Вариант 2 |
| В двух склянках без этикеток находятся порошки: оксида кальция, и оксида меди (II). Как различить эти вещества, не проводя химических опытов? Как химическими опытами подтвердить наличие в склянках именно этих веществ? | В двух склянках без этикеток находятся растворы: в одной – раствор соляной кислоты, а в другой – гидроксида калия. Как химическими опытами подтвердить, в какой склянке находится каждое из веществ? |
| Задача 2 |
| Очистите химическим путём железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа(III) и гидроксид железа(III) | Химическим способом отмойте пробирку, загрязнённую на практическом занятии. |
| Задача 3 |
| После практической работы остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения. Мотивированный ответ и результаты опытов запишите в произвольной форме. | В склянке без этикетки находится бесцветный раствор. Предполагают, что это раствор фенолфталеина. Проведите опыт подтверждающий или опровергающий это предположение. Мотивированный ответ и результаты опытов запишите в произвольной форме. |
| Задача 4 |
| Из имеющихся на столе реактивов получите несколькими способами сульфат меди (II). | В вашем распоряжении есть магний, ок- сид магния, гидроксид магния, соляная кислота. Сколькими способами вы сможете получить хлорид магния, ис-пользуя эти реактивы. |
| Задача 5 |
| Получите опытным путём из хлорида железа (III) оксид железа (III)/ | Получите из хлорида меди (II) оксид меди (II) при помощи двух реакций |
Составить уравнения проводимых реакций.
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:







 Рис. 1
Рис. 1 Рис. 2
Рис. 2





















