Просмотр содержимого документа
«Презентация к уроку по теме :"Кислород и сера"»


КИСЛОРОД и СЕРА
элементы VIA группы периодической системы
Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ , что означает «рождающие руды»
Ряды
Группы элементов
III
II
VII
VI
V
VIII
I
IV
Н
1
Не
2
1
1
s
1,008
4,003
Водород
Гелий
Be
6
С
4
В
7
N
8
3
p
2
2
3
Ne
9
Li
5
F
О
6,941
9.012
14.0067
18.998
15,999
12,011
10,811
20.179
Углерод
Неон
Кислород
Азот
Фтор
Вор
Бериллий
Литий
d
Ar
3
Al
13
3
Na
11
Mg
S
12
16
18
Si
14
P
15
17
Cl
26.981
32,064
24.305
39.948
22,9898
28,086
30.974
35,453
Сера
Литий
Аргон
Алюминий
Натрий
Хлор
Фосфор
Кремний
26
27
Ni
28
Fe
Co
Ti
23
22
V
Ca
19
4
20
К
4
21
Sc
Cr
25
Mn
24
58.933
58.71
47.90
50,942
39,098
40.078
55,847
44,956
54,938
51,996
Железо
Кобальт
Титан
Ванадий
Никель
Кальций
Калий
Хром
Марганец
Скандий
Cu
29
32
34
Se
Ge
5
36
Kr
30
Zn
35
33
As
Br
31
Ga
63,546
78.96
72.61
83.80
74.922
79,904
65,37
69,72
Германий
Селен
Медб
Криптон
Галлий
Бром
Цинк
Мышьяк
45
Pd
46
44
Ru
Rh
37
Y
Rb
Te
39
43
6
5
41
38
Zr
Nb
40
Mo
Sr
42
106.4
102.91
101,07
85,47
83,906
97.9064
95,94
92.906
91.22
87,62
Рутений
Родий
Палладий
Рубидий
Иттрий
Технеций
Стронций
Молибден
Ниобий
Цирконий
51
Sb
48
Cd
47
Ag
7
52
Te
I
50
Sn
49
54
In
53
Xe
112.41
107.87
121.75
126.90
114.82
131.30
116.71
127.60
Сурьма
Серебро
Кадмий
Теллур
Олово
Йод
Индий
Ксенон
77
Pt
76
78
Os
Ir
Re
Ba
56
W
Cs
55
8
*La
6
Ta
Hf
75
74
57
73
72
137.33
195,09
192,22
132,91
190,2
186.207
183.85
138.905
180.95
178.49
Барий
Иридий
Платина
Осмий
Цезий
Рений
Вольфрам
Лантан
Тантал
Гафний
Hg
Au
Pb
82
85
Bi
83
At
Tl
81
Po
84
9
Rn
86
80
79
207.2
209.99
208.98
204,37
208.99
(222)
196,99
200,59
Свинец
Астат
Висмут
Таллий
Понийт
Радон
Золото
Ртуть
108
109
Hs
Mt
Ra
87
88
Fr
*Ac
10
Rf
7
Bh
Db
Sg
107
89
104
105
106
266,14
223.02
226,03
265,132
262.11
227.03
262.12
261,11
263.12
Радий
Франций
Хассий
Мейтнерий
Борий
Резерфордий
Дубний
Актиний
Сиборгий

Электронные конфигурации атома:
Валентность
кислорода
равна двум (может быть 3 и 4 с учётом донорно-акцепторных
связей )
Степени окисления КИСЛОРОДА:
-2, 0, +2

Вещ-во
Агрегатное состояние при н. у.
Кислород
O 2
Газ
Цвет
Озон
O 3
Газ
Бесцветный, в жидком состоянии - голубой
запах
Без Запаха
t 0 плавления 0 C
Синий
t 0 кипения 0 C
-218,2
Характерный резкий, но приятный запах
-182,8
-251
-112

2KMnO4 = K2MnO4 + MnO2 + O2
2H 2 O 2 MnO2 2 H 2 O + O 2

Горение магния
2 Mg + O 2 = 2 MgO
ВАСИЛИЙ КАДЕВИЧ 2008г.

Кислород непосредственно реагирует со всеми простыми веществами , кроме золота , платины и галогенов.
В кислороде могут гореть даже те вещества, которые не горят на воздухе.
3Fe+2O 2 = Fe 3 O 4 ( железная окалина)

Горение фосфора в кислороде
4 P + 5 O 2 = 2 P 2 O 5
Горение углерода в кислороде
С+О 2 = СО 2

- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.
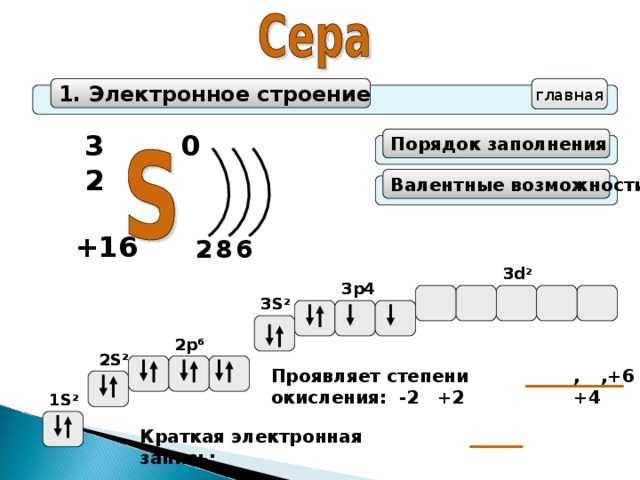
1. Электронное строение
главная
32
0
Порядок заполнения
Валентные возможности
+16
6
8
2
3d
3d 2
3p4
3p4
3S 2
3S 2
2p 6
2p 6
2S 2
2S 2
,+4
,+6
Проявляет степени окисления: -2 +2
1S 2
1S 2
Краткая электронная запись:

2. Аллотропия
главная
Существует несколько аллотропных модификаций серы.
моноклинная
ромбическая
пластическая
Причина аллотропии в разном строении кристаллов.
Наиболее устойчивой модификацией является
ромбическая сера.
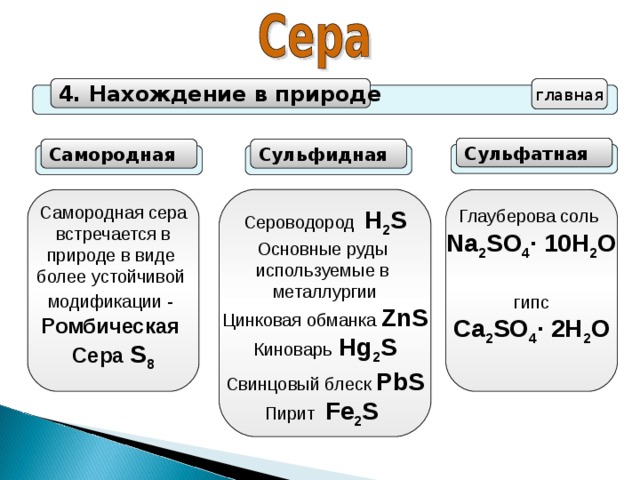
4. Нахождение в природе
главная
Сульфатная
Самородная
Сульфидная
Самородная сера
встречается в
природе в виде
более устойчивой
модификации -
Ромбическая
Сера S 8
Сероводород Н 2 S
Основные руды
используемые в
металлургии
Цинковая обманка ZnS
Киноварь Нg 2 S
Свинцовый блеск PbS
Пирит Fe 2 S
Глауберова соль
Na 2 SO 4 · 10H 2 O
гипс
Ca 2 SO 4 · 2H 2 O

Сера в организме
Сера — один из биогенных элементов .
Сера входит в состав некоторых аминокислот ( цистеин , метионин ), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков).
Человек содержит примерно 2 г серы на 1 кг своего веса.
 S -2 ) 1) Сера реагирует со щелочными металлами без нагревания: 2 Na + S = Na 2 S c остальными металлами (кроме Au , Pt ) - при повышенной t° : 2Al + 3S = t° = Al 2 S 3 Zn + S = t° = ZnS 2) С некоторыми неметаллами сера образует бинарные соединения: H 2 + S = H 2 S 2P + 3S = P 2 S 3 C + 2 S = CS 2 " width="640"
S -2 ) 1) Сера реагирует со щелочными металлами без нагревания: 2 Na + S = Na 2 S c остальными металлами (кроме Au , Pt ) - при повышенной t° : 2Al + 3S = t° = Al 2 S 3 Zn + S = t° = ZnS 2) С некоторыми неметаллами сера образует бинарные соединения: H 2 + S = H 2 S 2P + 3S = P 2 S 3 C + 2 S = CS 2 " width="640"
Окислительные свойства серы ( S 0 + 2ē = S -2 )
1) Сера реагирует со щелочными металлами без нагревания:
2 Na + S = Na 2 S
c остальными металлами (кроме Au , Pt ) - при повышенной t° :
2Al + 3S = t° = Al 2 S 3
Zn + S = t° = ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H 2 + S = H 2 S
2P + 3S = P 2 S 3
C + 2 S = CS 2
 S +2 ; S 0 - 4ē = S +4 ; S 0 - 6ē = S +6 ) 3) c кислородом: S + O 2 =t°= S +4 O 2 2S + 3O 2 =t°pt= 2S +6 O 3 4) c галогенами (кроме йода): S + Cl 2 = S +2 Cl 2 5) c кислотами - окислителями: S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O " width="640"
S +2 ; S 0 - 4ē = S +4 ; S 0 - 6ē = S +6 ) 3) c кислородом: S + O 2 =t°= S +4 O 2 2S + 3O 2 =t°pt= 2S +6 O 3 4) c галогенами (кроме йода): S + Cl 2 = S +2 Cl 2 5) c кислотами - окислителями: S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O " width="640"
Восстановительные свойства сера проявляет в реакциях с сильными окислителями: ( S 0 - 2ē = S +2 ; S 0 - 4ē = S +4 ; S 0 - 6ē = S +6 )
3) c кислородом:
S + O 2 =t°= S +4 O 2
2S + 3O 2 =t°pt= 2S +6 O 3
4) c галогенами (кроме йода):
S + Cl 2 = S +2 Cl 2
5) c кислотами - окислителями:
S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O

- Вулканизация каучука
- Получение эбонита
- Производство спичек, пороха
- В борьбе с вредителями сельского хозяйства
- Для медицинских целей (серные мази для лечения кожных заболеваний)
- Для получения серной кислоты
ВАСИЛИЙ КАДЕВИЧ 2008г.





















 S -2 ) 1) Сера реагирует со щелочными металлами без нагревания: 2 Na + S = Na 2 S c остальными металлами (кроме Au , Pt ) - при повышенной t° : 2Al + 3S = t° = Al 2 S 3 Zn + S = t° = ZnS 2) С некоторыми неметаллами сера образует бинарные соединения: H 2 + S = H 2 S 2P + 3S = P 2 S 3 C + 2 S = CS 2 " width="640"
S -2 ) 1) Сера реагирует со щелочными металлами без нагревания: 2 Na + S = Na 2 S c остальными металлами (кроме Au , Pt ) - при повышенной t° : 2Al + 3S = t° = Al 2 S 3 Zn + S = t° = ZnS 2) С некоторыми неметаллами сера образует бинарные соединения: H 2 + S = H 2 S 2P + 3S = P 2 S 3 C + 2 S = CS 2 " width="640"
 S +2 ; S 0 - 4ē = S +4 ; S 0 - 6ē = S +6 ) 3) c кислородом: S + O 2 =t°= S +4 O 2 2S + 3O 2 =t°pt= 2S +6 O 3 4) c галогенами (кроме йода): S + Cl 2 = S +2 Cl 2 5) c кислотами - окислителями: S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O " width="640"
S +2 ; S 0 - 4ē = S +4 ; S 0 - 6ē = S +6 ) 3) c кислородом: S + O 2 =t°= S +4 O 2 2S + 3O 2 =t°pt= 2S +6 O 3 4) c галогенами (кроме йода): S + Cl 2 = S +2 Cl 2 5) c кислотами - окислителями: S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O " width="640"












