Просмотр содержимого документа
«Презентация "Кислород. Озон." 8 класс"»

Глава 2
Кислород. горение
02.11.20
Озон. Аллотропия кислорода
Чернецова Н.И.
Учитель химии

- Сформировать представления об аллотропии на примере кислорода.
- Познакомить с химическими свойствами озона, показать различия в свойствах кислорода и озона.
- Рассмотреть физиологическое действие озона и экологические проблемы, связанные с озоном.
- Основные понятия.
- Аллотропия, аллотропные модификации, озоновый экран.


(Это соли и оксиды)

- Знак элемента – О
- Порядковый номер- 8
- Относительная атомная масса – 16
- Валентность – II
- Степень окисления -2
- Молекула в-ва – О 2
- Относительная молекулярная масса - 32

О 3
озон
(простое вещество)
О 2
кислород
(простое вещество)
- К. В. Шееле 1772 г.
- Дж. Пристли 1774 г.
- А. Лавуазье 1777г.

- Впервые озон обнаружил в 1785 голландский физик М. ван Марум по характерному запаху (свежести) и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр.
- Однако как новое вещество он описан не был , т.к. ван Марум считал, что образуется особая «электрическая материя».

Кристиан Фридрих Шёнбей
- Термин « Озон» предложил немецкий химик
- X.Ф. Шёнбейн в 1840 г.,
- Озон вошёл в словари в конце 19в.
- Многие источники именно ему отдают приоритет открытия озона в 1839 г .
( 1799 – 1868 )

- 1772 год. Карл Вильгельм Шееле
(шведский учёный) хотел раскрыть загадку огня и при этом неожиданно обнаружил, что воздух — не элемент, а смесь двух газов, которые он называл воздухом «огненным» и воздухом «негодным».
- Это было величайшим из всех открытий Шееле.
- В 1777 г. был опубликован труд Шееле «Химический трактат о воздухе и огне», где он описал получение и свойства «огненного воздуха» и указал, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» – кислорода и «флогистированного» – азота
- (Шееле до конца жизни оставался сторонником теории флогистона).
- Однако приоритет открытия кислорода принадлежит Джозефу Пристли, который описал его в 1774 г. независимо от Шееле.
(1742–1786)

- 1774 год. Джозеф Пристли , изучая состав воздуха, пытался выяснить, какие его составляющие могут выделиться из химических веществ при их нагревании. Нагревая оксид ртути (II), он получил газ и назвал его «дефлогистированным воздухом».
- Исследуя свойства полученного газа, Пристли обнаружил, что зажженная свеча горела в нем ослепительно ярко и что он поддерживает дыхание.
- Позднее А. Лавуазье назвал этот газ «кислородом».
(1733-1804)
- Пристли вошел в историю не только как первооткрыватель кислорода, но и как ученый, открывший процесс фотосинтеза.
- Прибор для получения кислорода ( Д. Пристли )

- Впервые количественный состав воздуха установил французский ученый
- Антуан Лоран Лавуазье ( 177 5 г . ) По результатам своего известного 12-дневного опыта он сделал вывод, что весь воздух в целом состоит из кислорода, пригодного для дыхания и горения, и азота, неживого газа, в пропорциях 1/5 и 4/5 объема соответственно.
- Ученый предложил «жизненный воздух» переименовать в « кислород », поскольку при сгорании в кислороде большинство веществ превращается в кислоты, а «удушливый воздух» – в « азот », т.к . он не поддерживает жизнь, вредит жизни.
( 1743-1794 )
- Установил, что воздух состоит из двух частей:
- Жизненный воздух- oxigenium-кислород,
- Безжизненный- nitrogenium- азот.

- Нахождение в природе. Получение
О 3
3О 2 ⇄ 2О 3
О 2
- 6СО 2 + 6Н 2 О = С 6 Н 12 О 6 + 6О 2 ↑
- Процесс фотосинтеза.

О 2
О 3
- Атмосфера (верхний слой) – «озоновый экран» Земли.
23% по массе.

- Содержание озона в атмосфере :
- Летом- до 7*10 -9 % (по объему),
- зимой- до 2*10 -10 %
- В атмосфере максимальная его концентрация на высоте 20-25 км , где озон образует слой, защищающий Землю от УФ- лучей.
- В чем причина образования «озоновых дыр»?

- Под воздействием солнечного излучения или электрического разряда (грозы)
- Окисление смолы хвойных деревьев
- В лаборатории:
- В озонаторах.
- Таким образом, кислород и озон – это два разных вещества, которые называются аллотропными видоизменениями.

О 2 О 3
О = О
M r = 32 M r = 48

О 2
- Не окисляет Au и Pt, окисляет многие металлы, образуя оксиды.
- 2Cu + O 2 = 2CuO
- Взаимодействует со всеми неметаллами, кроме галогенов, (исключением F 2 )
- S+ O 2 = SO 2
- Горение сложных веществ:
2H 2 S + 3O 2 = 2H 2 O + 2SO 2
О 3
- Очень сильный окислитель, намного реакционноспособнее, чем кислород.
- Окисляет почти все металлы
- ( исключение: Au и Pt, и иридий)
- 2Ag + O 3 = Ag 2 O + O 2 ↑
(комнатная температура)
- Окисляет многие неметаллы .
C + 2O 3 = CO 2 + 2O 2
- Окисление сложных веществ
2KI + O 3 + H 2 O = 2KOH + I 2 + O 2 ↑

- Химические свойства озона
- Озон неустойчив: О 3 = О 2 + О*
- О 3 более сильный окислитель, чем кислород из – за образования атомарного кислорода.
- PbS + 4О 3 = PbSO 4 + 4О 2 ↑
- 2К I + O 3 + H 2 O = 2 KOH + I 2 + О 2 ↑ –
- ( качественная реакция на озон:
- бумажка смоченная раствором К I и крахмала – синеет).

- Аллотропия (от греческих слов « allos » – другой и « tropos » – образ, способ)
- Аллотропия - с пособность атомов одного элемента
образовывать несколько простых веществ.
- Простые вещества, образованные одним и тем же химическим элементом называются АЛЛОТРОПНЫМИ ВИДОИЗМЕНЕНИЯМИ или АЛЛОТРОПНЫМИ МОДИФИКАЦИЯМИ.
- ВЫВОД: Вещества кислород и озон – это аллотропные модификации химического элемента КИСЛОРОДА!!!

- Значение кислорода и озона в природе.
О 3
- Озоновый слой поглощает солнечные излучения,
- губительные для всего живого на ЗЕМЛЕ.
«озоновые дыры»
О 2
дыхание
(животные)
О 2
гемоглобин
Н 2 О + СО 2
хлорофилл
фотосинтез
(растения)
Равновесие всего живого в
природе.
Презентация подготовлена для проведения урока « Общая характеристика неметаллов » в 9 классе по теме
« Неметаллы ». Служит для индивидуальной речи учителя.

- Воздействие озона на организм человека
- Несколько микрограмм озона в литре воздуха – раздражение дыхательных путей, головокружение, усталость;
- несколько миллиграмм – смертельно опасно.
Свойства (н.у.)
Кислород (О 2 )
Агрегатное состояние
Озон (О 3 )
Цвет
Запах
Относительная
Молекулярная масса
Плотность
Т кипения, 0 С
Растворимость в воде при 20 0 С, в мл на 100г воды
Токсичность
Химические свойства
Бактерицидные свойства
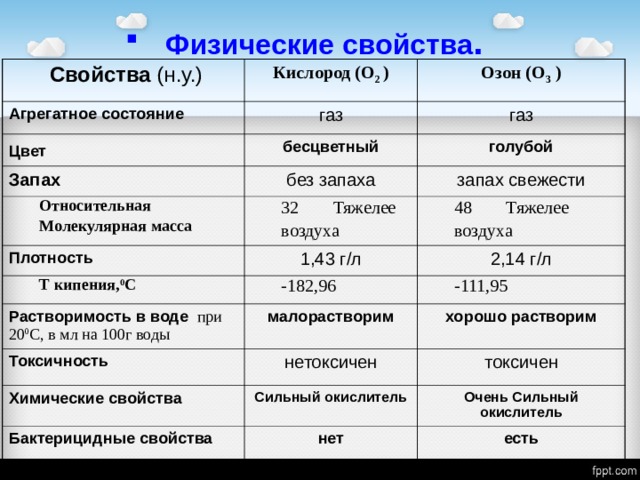
Свойства (н.у.)
Кислород (О 2 )
Агрегатное состояние
Озон (О 3 )
газ
Цвет
Запах
бесцветный
газ
голубой
без запаха
Относительная
Молекулярная масса
запах свежести
32 Тяжелее воздуха
Плотность
Т кипения, 0 С
1,43 г / л
48 Тяжелее воздуха
2,14 г / л
-182,96
Растворимость в воде при 20 0 С, в мл на 100г воды
-111,95
малорастворим
Токсичность
хорошо растворим
нетоксичен
Химические свойства
токсичен
Сильный окислитель
Бактерицидные свойства
Очень Сильный окислитель
нет
есть

1. Что такое аллотропия?
2. Назовите фамилии трех ученых, открывших кислород.
3. В результате какого процесса в природе образуется кислород?
4. Какая химическая реакция происходит при грозовых разрядах?
5. Газ, образующий защитную оболочку Земли.
6. В чём одна из причин многообразия веществ?

- N 2 +O 2 ⟶
- K + O 2 ⟶
- Cu + O 2 ⟶
- Mg + O 2 ⟶
- PH 3 + O 2 ⟶

§ 26,стр. 85-87,
- Упр.1,2 (устно), тесты
- В тетрадь ТАБЛИЦА:
«Физические свойства кислорода и озона».
- Подготовить краткое сообщение
«Экологические проблемы, связанные с озоном».











































