Просмотр содержимого документа
«Презентация на тему "Карбоновые кислоты"»

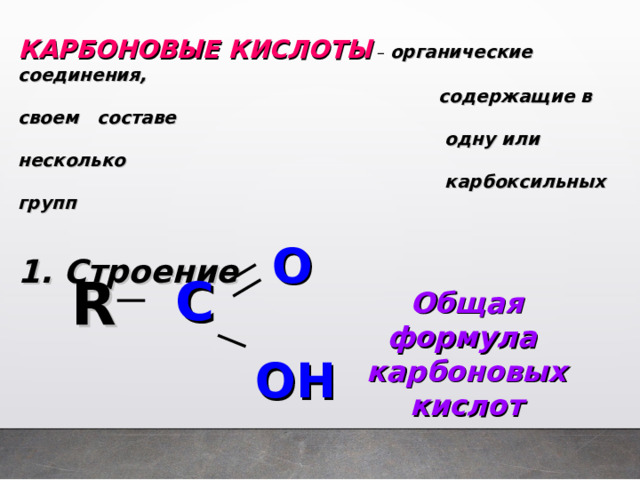
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,
содержащие в своем составе
одну или несколько
карбоксильных групп
1. Строение
O
OH
R
Общая формула
карбоновых кислот
C

С n H 2n O 2 Общая формула карбоновых кислот Атом углерода карбоксильной группы находится в состоянии sp 2 – гибридизации, он образует три сигма-связи .
Формула для расчета
молекулярной массы
предельных карбоновых кислот
14n +32

КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
ПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУПП
ОДНООСНОВНЫЕ
МНОГООСНОВНЫЕ
- МЕТАНОВАЯ КИСЛОТА
- ЭТАНОВАЯ КИСЛОТА
- БУТАНОВАЯ КИСЛОТА
- ЩАВЕЛЕВАЯ КИСЛОТА
- ЛИМОННАЯ КИСЛОТА
- ЯНТАРНАЯ КИСЛОТА
R – COOH
HOOC – R – COOH

КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
ПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТА
ПРЕДЕЛЬНЫЕ
НЕПРЕДЕЛЬНЫЕ
- МЕТАНОВАЯ КИСЛОТА
- ЭТАНОВАЯ КИСЛОТА
- БУТАНОВАЯ КИСЛОТА
- ОЛЕИНОВАЯ КИСЛОТА
- ЛИНОЛЕВАЯ КИСЛОТА
- ЛИНОЛЕНОВАЯ КИСЛОТА
АРОМАТИЧЕСКИЕ

2 . НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ
Алгоритм составления названий:
1. Найдите главную (самую длинную) цепь углеводородных атомов (включая атом карбоксильной группы);
2. Пронумеруйте углеродные атомы главной цепь начиная с углерода карбоксильной группы;
3. Назовите соединение по алгоритму углеводородов;
4. В конце названия допишите суффикс «ов» и окончание «ая» и слово «кислота»
АЛКАН + ОВ + АЯ КИСЛОТА

МЕТАН ОВ АЯ КИСЛОТА
(МУРАВЬИНАЯ КИСЛОТА)
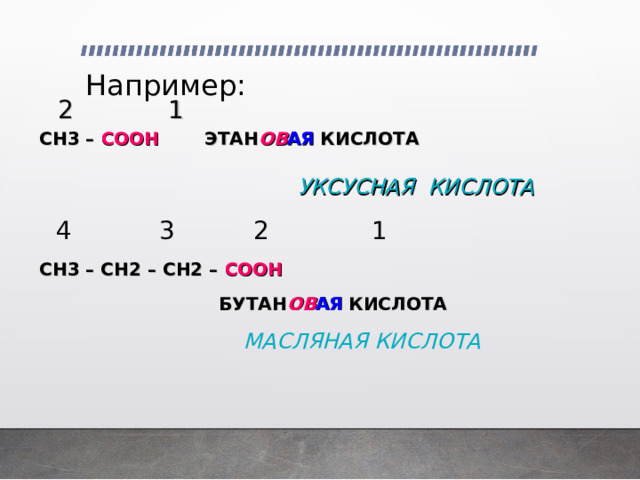
Например:
2 1
СН3 – СООН ЭТАН ОВ АЯ КИСЛОТА
4 3 2 1
СН3 – СН2 – СН2 – СООН
БУТАН ОВ АЯ КИСЛОТА
МАСЛЯНАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА

3
5
4
1
2
СН 3 – СН 2 – СН 2 – СН 2 – СООН
ПЕНТАН ОВ АЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
1
2
НООС – СООН
ЭТАН ДИ ОВ АЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)

1
2
3
СН 3 – СН ( ОН ) – СООН
2 – ГИДРОКСО ПРОПАН ОВ АЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)

ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ
Для предельных карбоновых кислот:
- УГЛЕРОДНОГО СКЕЛЕТА
- МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ)
Для непредельных карбоновых кислот:
- УГЛЕРОДНОГО СКЕЛЕТА
- ПОЛОЖЕНИЯ КРАТНОЙ СВЯЗИ
- МЕЖКЛАССОВАЯ
 " width="640"
" width="640"
3. Свойства
3.1.Физические
Жидкости с характерным резким запахом, хорошо растворимые в воде
С 1 – С 3
Вязкие маслянистые жидкости с неприятным запахом, плохо растворимые
в воде
С 4 – С 9
Твердые вещества,
не имеющие запаха, не растворимые в воде
C 10 и
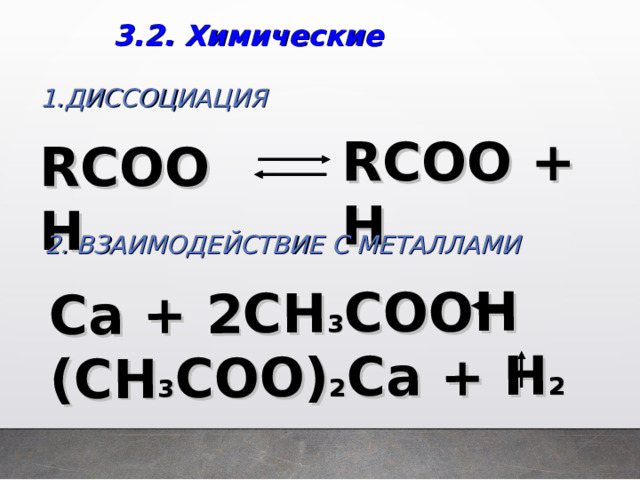
Ca + 2CH 3 COOH
(CH 3 COO) 2 Ca + H 2
3.2. Химические
RCOO + H
RCOOH
2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
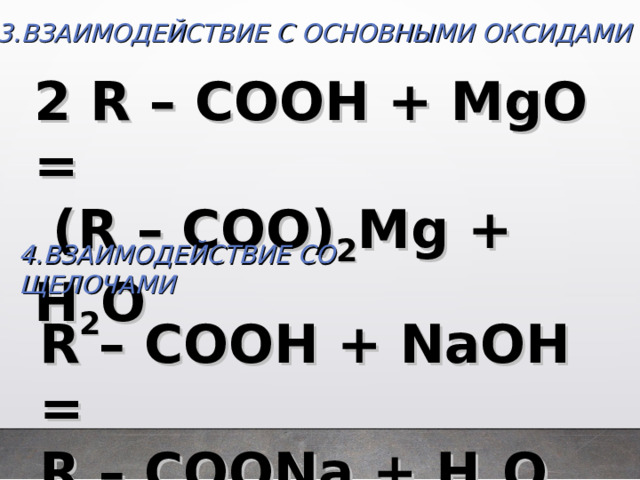
3.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
2 R – COOH + MgO =
(R – COO) 2 Mg + H 2 O
4 .ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ
R – COOH + NaOH =
R – COONa + H 2 O

5 .РЕАКЦИИ ПРИСОЕДИНЕНИЯ
C n H 2n-1 + Br 2 C n H 2n-1 Br 2 COOH
6 . РЕАКЦИИ ЗАМЕЩЕНИЯ
RCH 2 COOH + Cl 2 RCHClCOOH + HCl

7. РЕАКЦИЯ ЭТЕРИФИКАЦИИ
R – COOH
+ HO – R 1
СПИРТ
КАРБОНОВАЯ КИСЛОТА
t 0 C, H +
R – COOR 1 – HOH
сложный эфир
![4. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И АЛЬДЕГИДОВ [ О ] СН 3 – СН 2 – ОН - Н 2 О ПЕРВИЧНЫЙ СПИРТ [ О ] СН 3 – СООН СН 3 – СОН - Н 2 О КАРБОНОВАЯ КИСЛОТА АЛЬДЕГИД](https://fsd.multiurok.ru/html/2022/04/05/s_624c8fb98a6cb/img16.jpg)
4. СПОСОБЫ ПОЛУЧЕНИЯ
- ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ
И АЛЬДЕГИДОВ
[ О ]
СН 3 – СН 2 – ОН
- Н 2 О
ПЕРВИЧНЫЙ СПИРТ
[ О ]
СН 3 – СООН
СН 3 – СОН
- Н 2 О
КАРБОНОВАЯ КИСЛОТА
АЛЬДЕГИД

2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ
Н +
СН 3 – СООС 2 Н 5
+ НОН
СН 3 – СООН + С 2 Н 5 ОН
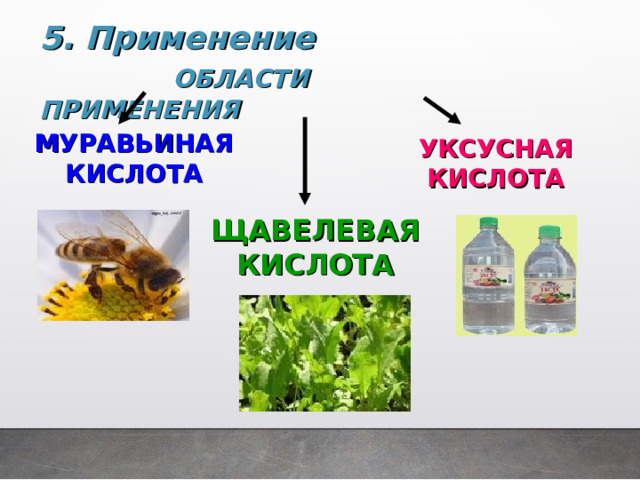
5. Применение
ОБЛАСТИ ПРИМЕНЕНИЯ
МУРАВЬИНАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА
ЩАВЕЛЕВАЯ
КИСЛОТА

Муравьиная кислота:
- в текстильной промышленности (в качестве протравы при крашении тканей);
- в кожевенной (при дублении кож);
- в пищевой (для консервирования фруктов);
- в медицине;
- в производстве некоторых полимеров

Уксусная кислота:
- в пищевой промышленности (для консервации);
- для получения полимеров, красителей, сложных эфиров, ацетатного шелка, негорючей фото - и кинопленки;
- Широко используются соли уксусной кислоты:
- ацетаты железа, хрома, алюминия в качестве протравы при крашении ткани;
- ацетат меди – для борьбы с вредителями с/х;
- ацетат свинца – для изготовления свинцовых белил

Щавелевая кислота:
- для отбеливания тканей;
- в производстве красителей;
- в кожевенной и деревообрабатывающей промышленности;
- для удаления ржавчины и накипи;
- в пищевой промышленности.

Домашнее задание: прочитать §25,26, законспектировать материал из презентации и выполнить задания из презентации слайд 24,25

ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ
ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ
- СН 3 – СН(СН 3 ) – СООН
- СН 3 – СН 2 – СН(СН 3 ) – СН(СН 3 ) – СООН
- СН 3 – СН = СН – СН(СН 3 ) – СООН
- СН 3 – СН = СН – СН(ОН) – СООН
- НООС – СН 2 – СН(СН 3 ) – СООН

ЗАДАНИЕ: Классифицируйте предложенные кислоты : 1. CH 3 – CH 2 – CH 2 – COOH 2. CH 3 – CH = CH – COOH 3. CH 3 – CH (CH 3 ) – CH (CH 3 ) - COOH 4. COOH - CH = CH – CH 2 – COOH 5 . CH 3 – CH = C - CH – COOH


















 " width="640"
" width="640"

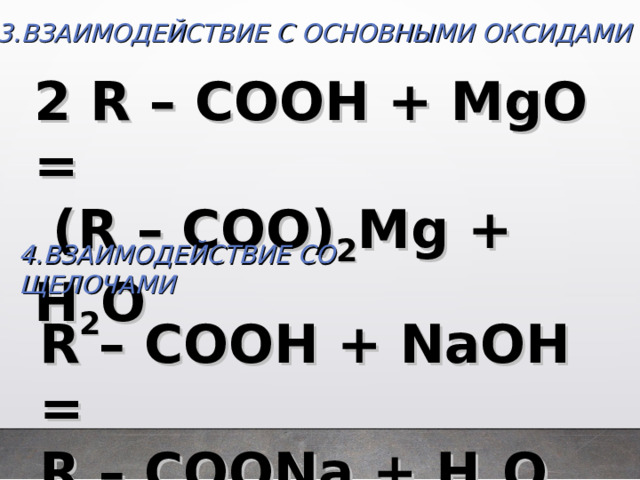


![4. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И АЛЬДЕГИДОВ [ О ] СН 3 – СН 2 – ОН - Н 2 О ПЕРВИЧНЫЙ СПИРТ [ О ] СН 3 – СООН СН 3 – СОН - Н 2 О КАРБОНОВАЯ КИСЛОТА АЛЬДЕГИД](https://fsd.multiurok.ru/html/2022/04/05/s_624c8fb98a6cb/img16.jpg)


















