
Строения атома. Изотопы


Бойль
Ньютон

Первый определил химию
как науку М. В. Ломоносов.
Он считал, что химия
должна строиться на точных
количественных данных
– «на мере и весе».
Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории. Оно сводится к следующим положениям, изложенным в работе «Элементы математической химии»:
Каждое вещество состоит из мельчайших, далее физически неделимых частиц (Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
- Молекулы находятся в постоянном, самопроизвольном движении.
3. Молекулы состоят из атомов (Ломоносов назвал их элементами).
4. Атомы характеризуются определенным размером и массой.
5. Молекулы могут состоять как из одинаковых, так и различных атомов.

По мысли английского ученого Р. Бойля, мир корпускул (молекул), их движение и «сплетение» очень сложны. Мир в целом и его мельчайшие части – это целесообразно устроенные механизмы. Английский ученый Дж. Дальтон рассматривал атом как мельчайшую частицу химического элемента, отличающуюся от атомов других элементов прежде всего массой. Большой вклад в атомно-молекулярное учение внесли французский ученый Ж. Гей-Люссак, итальянский ученый А. Авогадро, русский ученый Д. И. Менделеев. В 1860 году в г. Карлсруэ состоялся международный конгресс химиков.
Благодаря усилиям итальянского ученого С. Канниццаро были приняты следующие определения атома и молекулы: молекула – «количество тела, вступающее в реакции и определяющее химические свойства»; атом – наименьшее количество элемента, входящее в частицы (молекулы) соединений.
Установленные С. Канниццаро атомные массы элементов послужили Д. И. Менделееву основной при открытии периодического закона.




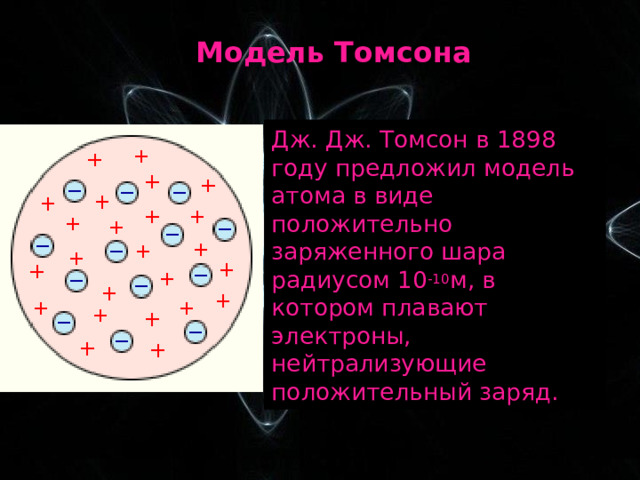
Модель Томсона
Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м, в котором плавают электроны, нейтрализующие положительный заряд.

Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт Резерфорда : поток ά-частиц, излучаемый радиоактивным источником, через узкую щель направлялся на тонкую золотую фольгу; при помощи флюоресцирующего экрана проводилась регистрация ά-частиц, которые в отсутствии фольги двигались узким пучком, вызывая на экране яркую вспышку
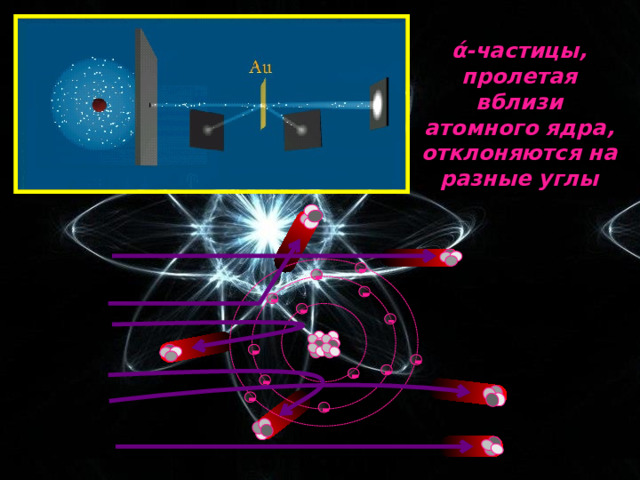
ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
-
-
-
-
-
-
-
-
-
-
-
-
-

Э. Резерфорд предложил планетарную модель атома : в центре находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нём заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.
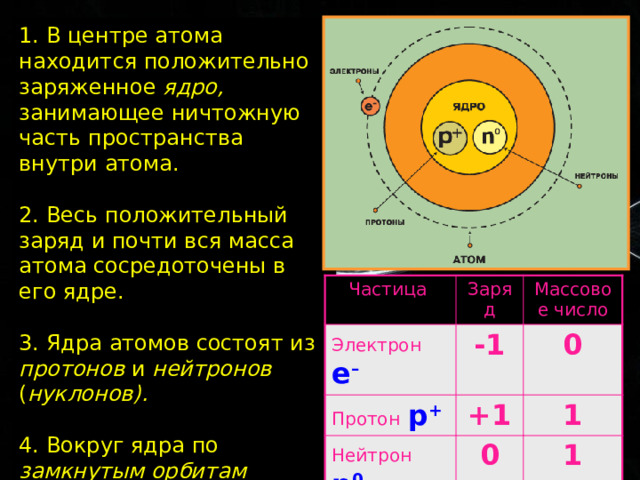
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов ( нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Частица
Электрон е –
Заряд
Протон р +
Массовое число
-1
0
Нейтрон n 0
+1
1
0
1
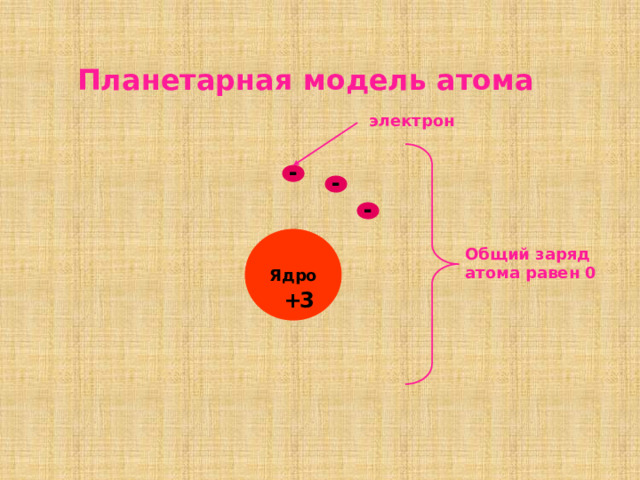
Планетарная модель атома
электрон
-
-
-
Общий заряд атома равен 0
Ядро
+
3

Современное изложение основных положений атомно-молекулярного учения:
- Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических - разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
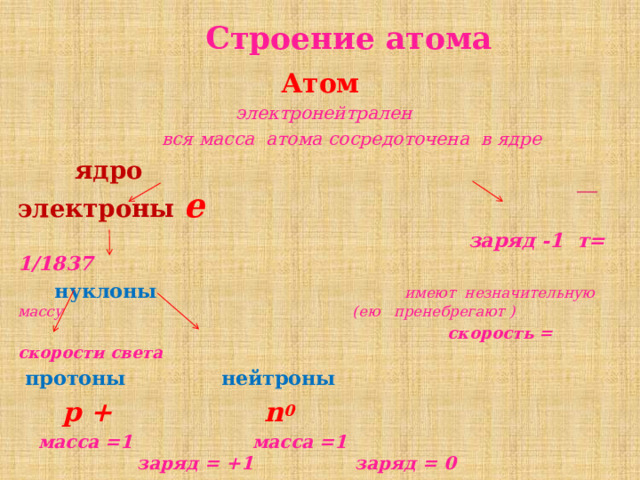
Строение атома
Атом
электронейтрален
вся масса атома сосредоточена в ядре
ядро электроны e
заряд -1 т= 1/1837
нуклоны имеют незначительную массу (ею пренебрегают )
скорость = скорости света
протоны нейтроны
p + n 0
массa =1 массa =1 заряд = +1 заряд = 0
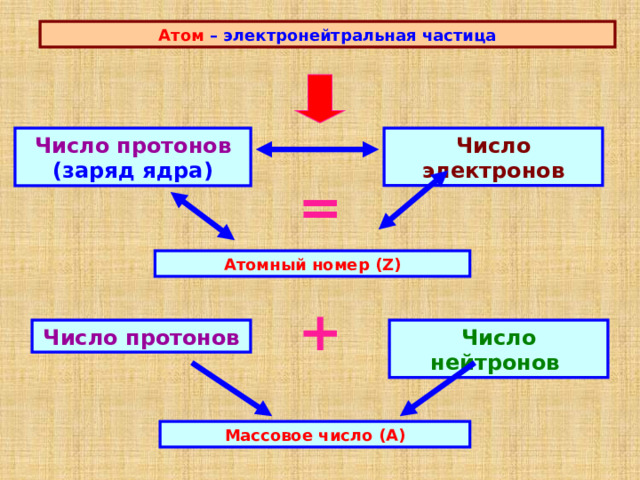
Атом – электронейтральная частица
Число протонов (заряд ядра)
Число электронов
=
Атомный номер (Z)
+
Число нейтронов
Число протонов
Массовое число (А)
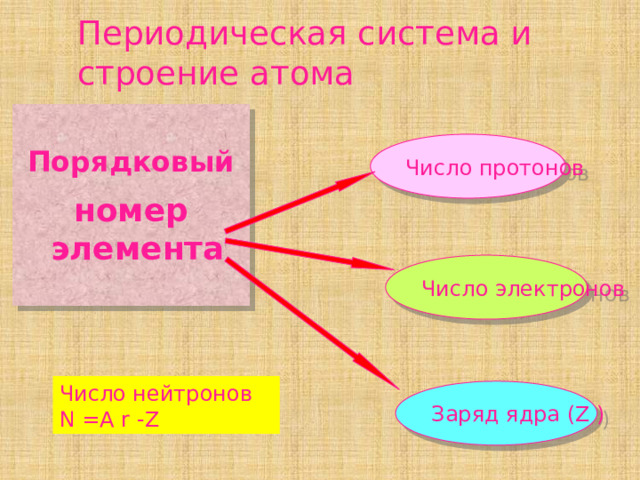
Периодическая система и строение атома
Порядковый
номер элемента
Число протонов
Число электронов
Число нейтронов N =A r -Z
Заряд ядра (Z )
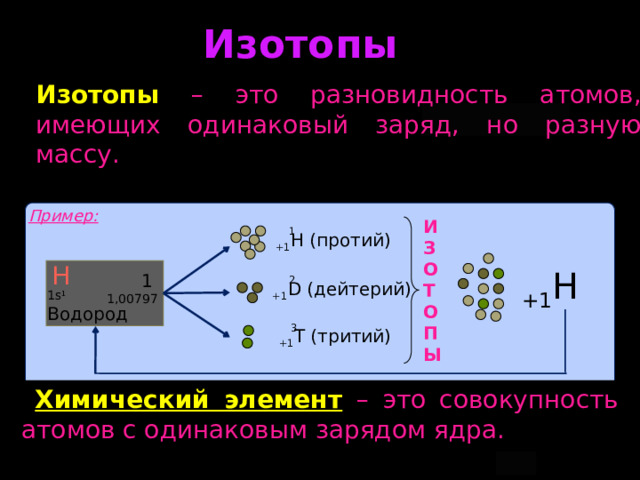
Изотопы
Изотопы – это разновидность атомов, имеющих одинаковый заряд, но разную массу.
Пример:
1
И
З
О
Т
О
П
Ы
+1 H (протий)
Н
2
+1 Н
1
1,00797
+1 D (дейтерий)
1s 1
Водород
3
+1 T (тритий)
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
22
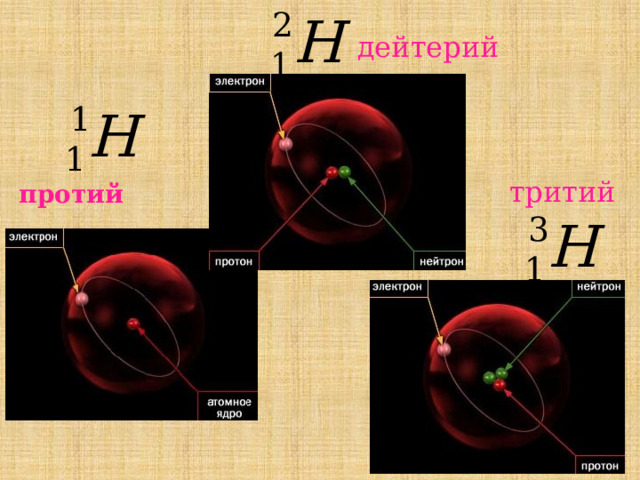
дейтерий
протий
тритий
протий

Домашнее задание: § 52, законспектировать материал и выполнить задание.
Определить количество электронов, протонов и нейтронов следующих элементов: ниобий, кадмий, свинец, серебро, аргон, астат.


















































