
СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ.ПРИМЕНЕНИЕ .
Автор: Калинина В.Н.
МБОУ СОШ №3 с. Огоньки Сахалин
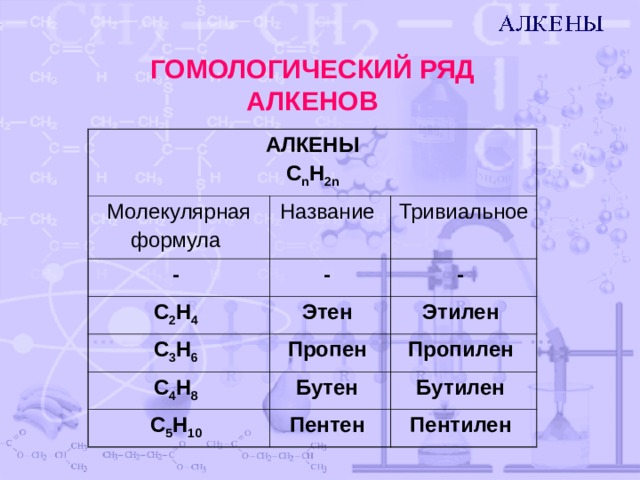
ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ
АЛКЕНЫ
С n H 2n
Молекулярная
формула
Название
-
-
Тривиальное
C 2 H 4
C 3 H 6
Этен
-
Пропен
Этилен
C 4 H 8
Пропилен
Бутен
С 5 H 1 0
Пентен
Бутилен
Пентилен
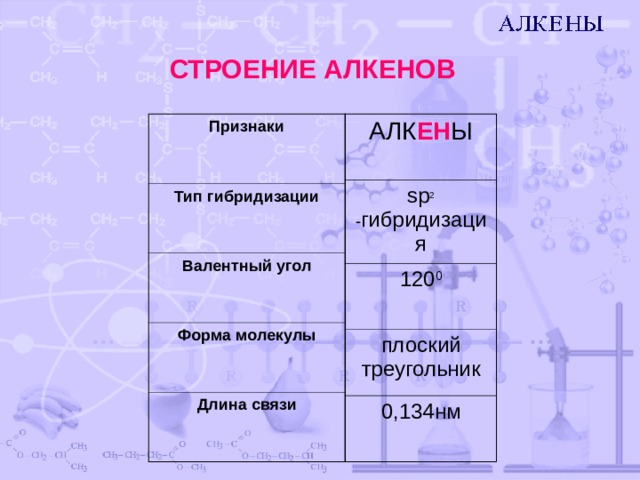
СТРОЕНИЕ АЛКЕНОВ
Признаки
АЛК ЕН Ы
Тип гибридизации
sp 2 - гибридизация
Валентный угол
1 20 0
Форма молекулы
плоский треугольник
Длина связи
0,134нм
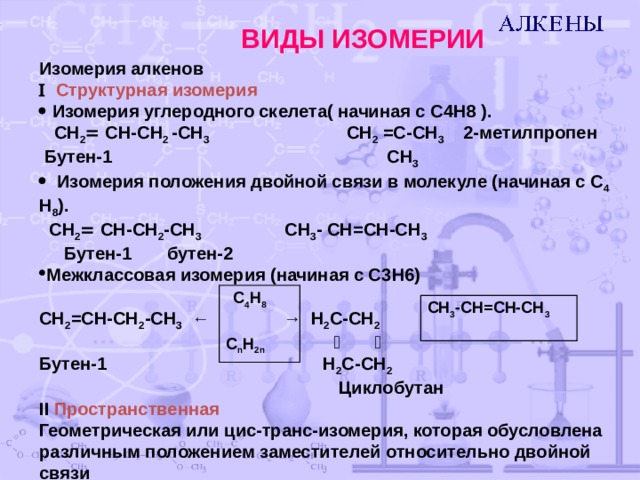
ВИДЫ ИЗОМЕРИИ
Изомерия алкенов
Структурная изомерия
Изомерия углеродного скелета( начиная с C 4 H 8 ).
CH 2 CH-CH 2 -CH 3 CH 2 =C-CH 3 2- метилпропен
Бутен -1 CH 3
Изомерия положения двойной связи в молекуле (начиная с C 4 H 8 ).
С H 2 CH-CH 2 -CH 3 С H 3 - CH=CH-CH 3
Бутен-1 бутен-2
- Межклассовая изомерия (начиная с С3 H 6)
CH 2 =CH-CH 2 -CH 3 ← → H 2 C-CH 2
Бутен-1 H 2 C - CH 2
Циклобутан
II Пространственная
Геометрическая или цис-транс-изомерия, которая обусловлена различным положением заместителей относительно двойной связи
C 4 H 8
C n H 2 n
СН 3 -СН=СН-СН 3

Физические свойства алкенов
Алкены имеют молекулярную кристаллическую решетку
С 1 -С 4 - бесцветные газы
С 5 -С 17 -бесцветные жидкости
С 18 -твердые вещества
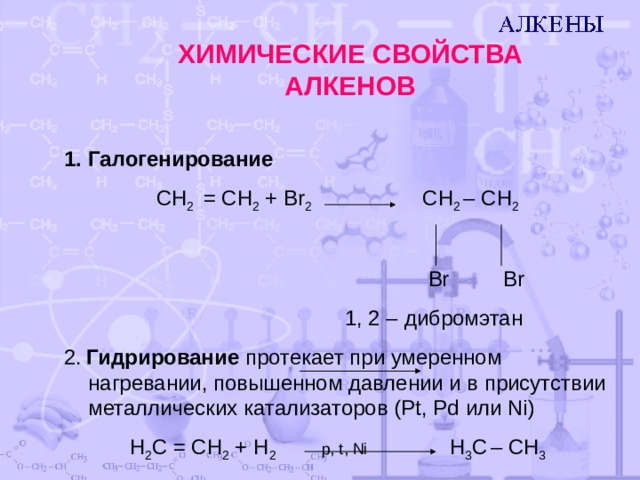
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
CH 2 = CH 2 + Br 2 CH 2 – CH 2
Br Br
1, 2 – дибромэтан
2. Гидрирование протекает при умеренном нагревании, повышенном давлении и в присутствии металлических катализаторов ( Pt, Pd или Ni )
H 2 C = CH 2 + H 2 p, t, Ni H 3 C – CH 3
этен этан

ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
3. Гидрогалогенирование
H 2 С = CH 2 + Н Br CH 3 – CH 2 Br
этен бромэтан
Правило Марковникова:
Атом водорода присоединяется к более гидрированному, а атом галогена – к менее гидрированному атому углерода при двойной связи.
4. Гидратация
CH 2 = CH 2 + Н – ОН t, H 2 SO 4 СН 3 – СН 2 ОН
этиловый спирт
5. Реакция полимеризации
nCH 2 = CH 2 t, p, кат. ( – CH 2 – CH 2 – ) n
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
6. Горение
C 2 H 4 +3O 2 2CO 2 + 2H 2 O
Этилен с кислородом образует взрывоопасную смесь.
7. Реакция окисления
3 СН 2 = СН 2 + 2KMnO 4 + 4H 2 O 3CH 2 – CH 2 + 2KOH + 2MnO 2
OH OH

ПОЛУЧЕНИЕ АЛКЕНОВ
1)Крекинг нефтепродуктов .
C 16 H 34 C 8 H 18 + C 8 H 16
гексадекан октан октен
2)Дегидрирование предельных углеводов .
CH 2 =CH-CH 2 -CH 3 +H 2
CH 3 -CH 2 -CH 2 -CH 3 бутен-1
CH 3 - CH = CH - CH 3 + H 2
бутен-2
3)Дегидратация спиртов (отщепление воды).
H 2 SO 4 , 170-180 C
CH 3 -CH 2 -OH CH 2 =CH 2 +H 2 O
4) Дегидрогалогенирование ( отщепление галогеноводорода ).
Br спирт
CH 3 -CH-CH 2 -CH 3 +NaOH CH3-CH=CH -СН 3 +NaBr+H2O
2-БРОМБУТАН бутен-2
5)Дегалогенирование.
Br Br
CH 3 -CH-CH-CH 3 +Zn CH 3 -CH=CH-CH 3 +ZnBr 2

Получение этена (этилена) в лабораторных условиях.
- В пробирку поместили 6 мл 96% концентрированной серной кислоты, 3мл этилового спирта и несколько крупинок оксида алюминия ( Al 2 O 3 ) для равномерного кипения смеси при нагревании.
- Закрыли пробирку пробкой с газоотводной трубкой и нагрели пробирку в пламени спиртовки.
- Выделяющейся газ пропустили в отдельную пробирку с раствором перманганата калия.
- Убедились в том, что раствор перманганата калия быстро обесцвечивается.
- Затем подожгли газ у конца газоотводной трубки. Отметим цвет пламени. (Этилен горит светящимся пламенем.) ВИДЕО
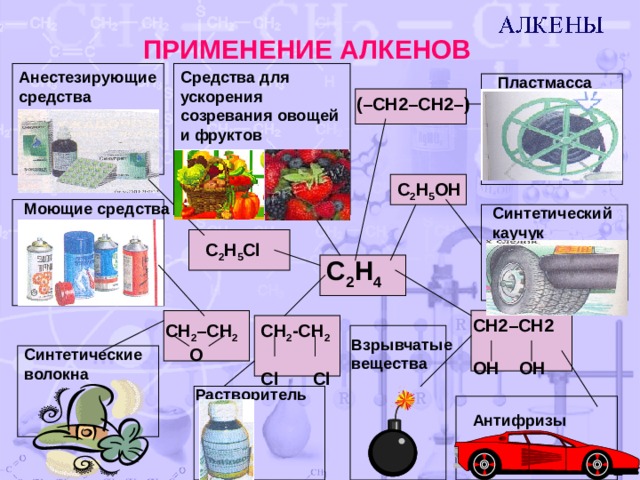
ПРИМЕНЕНИЕ АЛКЕНОВ
Средства для ускорения созревания овощей и фруктов
Анестезирующие средства
Пластмасса
(–CH2–CH2–)
C 2 H 5 OH
Моющие средства
Синтетический каучук
C 2 H 5 Cl
C 2 H 4
CH2–CH2
OH OH
CH 2 –CH 2
O
CH 2 -CH 2
Cl Cl
Взрывчатые вещества
Синтетические волокна
Растворитель
Антифризы

Спасибо за внимание!



























