Просмотр содержимого документа
«Презентация по химии: химические свойства водорода»

"Химические свойства водорода. Применение водорода"

Химический знак – Порядковый номер – Относительная атомная масса Ar (Н) = Химическая формула – Относительная молекулярная масса Mr (Н) = Валентность - .

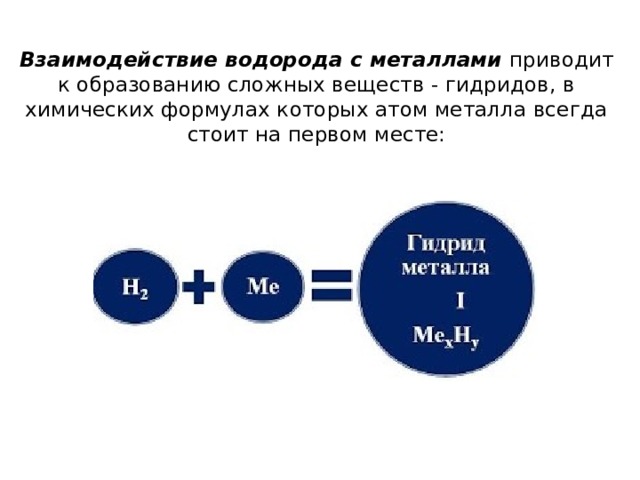
Взаимодействие водорода с металлами приводит к образованию сложных веществ - гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

- Н 2 + 2Li = 2LiH
- Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
- СаH 2 + 2Н 2 О = Са(ОН) 2 + 2Н 2 ↑
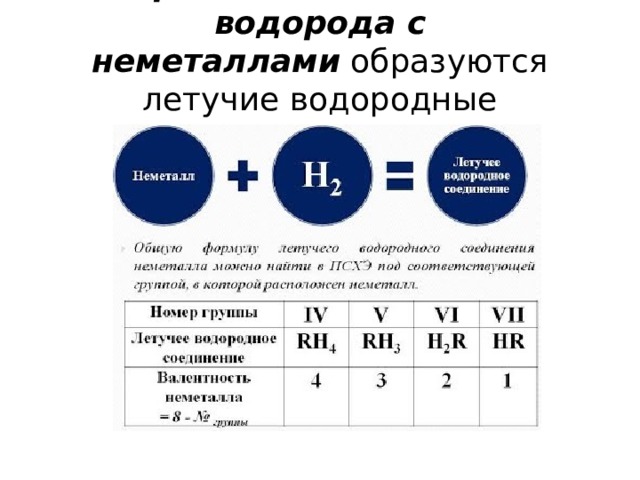
При взаимодействии водорода с неметаллами образуются летучие водородные соединения.

1). С кислородом Водород образует воду:
2Н 2 + О 2 = 2Н 2 О + Q
(смесь 2 объемов Н 2 и 1 объема О 2 называется гремучим газом ) .
2). С галогенами Водород образует галогеноводороды, например:
Н 2 + Cl 2 = 2НСl
3). С азотом Водород взаимодействует с образованием аммиака:
ЗН 2 + N 2 = 2NН 3
4). При нагревании Водород энергично реагирует с серой :
Н 2 + S = H 2 S (сероводород),
5). С чистым углеродом Водород может реагировать без катализатора только при высоких температуpax:
2Н 2 + С (аморфный) = СН 4 (метан)

Водород вступает в реакцию замещения с оксидами металлов , при этом образуются в продуктах вода и восстанавливается металл. Водород - проявляет свойства восстановителя:
Водород используется для восстановления многих металлов , так как отнимает кислород у их оксидов:
CuO + H 2 = Cu + H 2 O ,
Fe 3 O 4 + 4H 2 = 3Fe + 4Н 2 О

























