
Лекция: Спирты и фенолы


Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
1. По числу гидроксильных групп спирты подразделяются на:
- - одноатомные (одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
- - многоатомные (две и более групп -ОН).
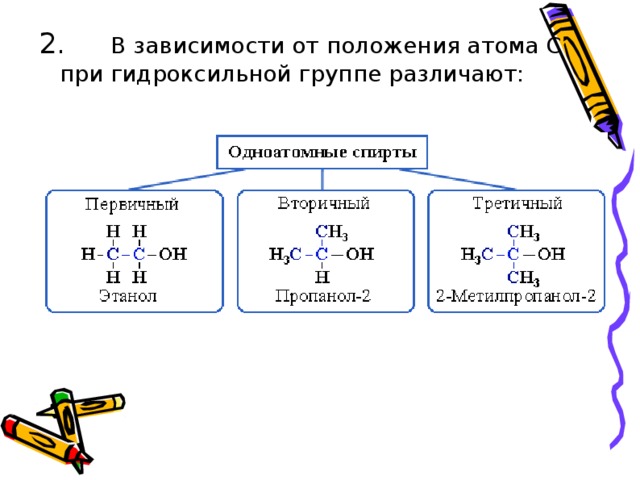
В зависимости от положения атома С при гидроксильной группе различают:
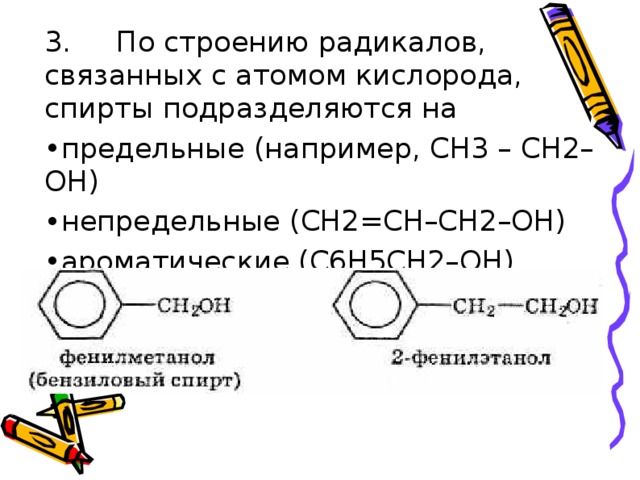
Предельные одноатомные спирты
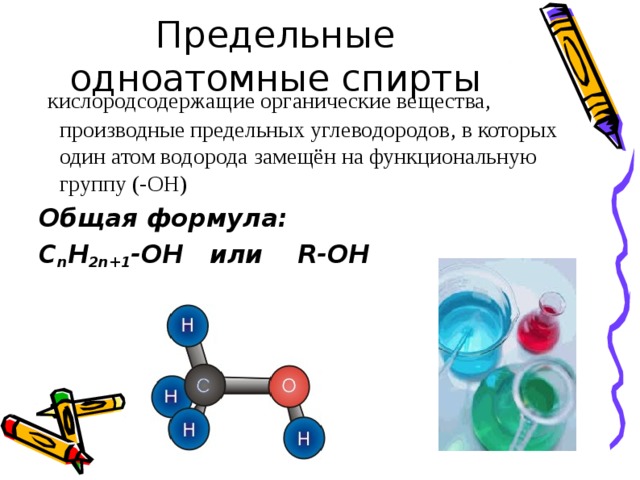
кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула:
C n H 2n+1 -OH или R-OH
1833 г. – Якоб Берцелиус определил молекулярную формулу этилового спирта – C 2 H 5 O Н

Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке ставится после суффикса "ол".
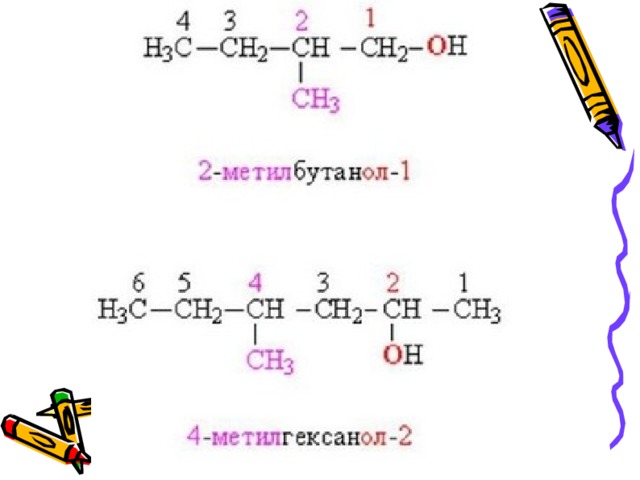

Изомерия спиртов
Для спиртов характерна структурная изомерия :
1. изомерия положения ОН-группы (начиная с С 3 );
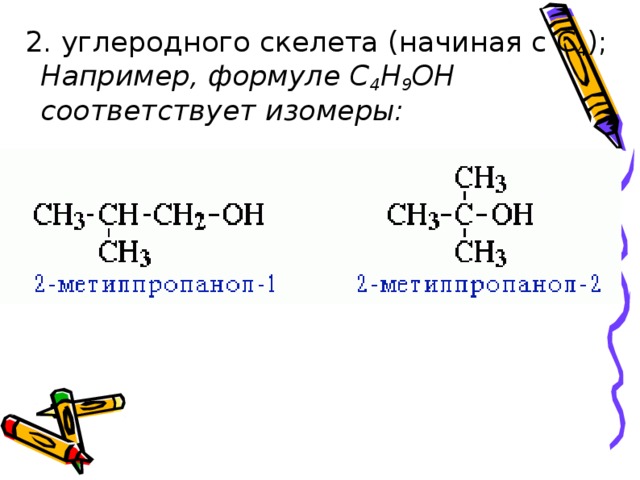
4 Например, формуле C 4 H 9 OH соответствует изомеры:
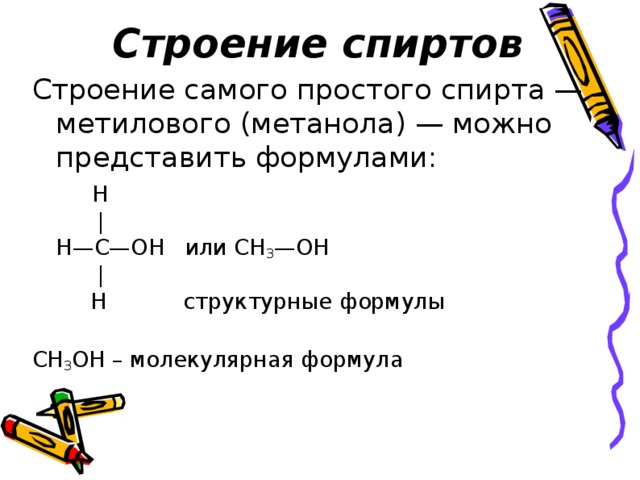
Строение спиртов
H | H—C—OH или CH 3 —OH | H структурные формулы
СН 3 ОН – молекулярная формула
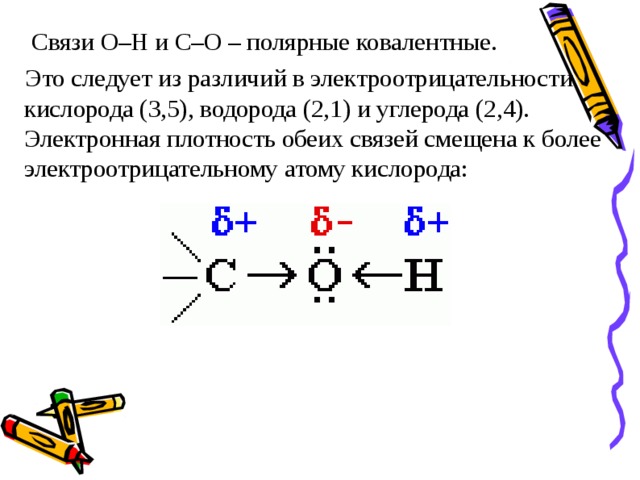
Связи О–Н и С–О – полярные ковалентные.
Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:

ФИЗИЧЕСКИЕ СВОЙСТВА
Агрегатное состояние :
С 1 -С 11 - жидкости
С 12 –С … - твердые вещества
Запах
С 1 -С 3 - «спиртовой» запах
С 4 -С 6 - «сивушный» запах
С 11 - запаха нет
Растворимость в воде,
высокая
легче воды
Б/цвета

Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость
(t кип =64,5; t пл =-98; ρ = 0,793г/см 3 ), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде .
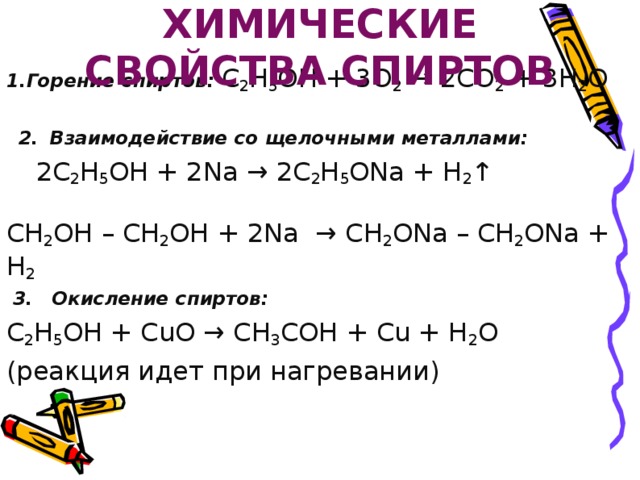
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
1.Горение спиртов: C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
2. Взаимодействие со щелочными металлами:
2C 2 H 5 OH + 2Na → 2C 2 H 5 ONa + H 2 ↑
СН 2 ОН – СН 2 ОН + 2Nа → СН 2 ОNа – СН 2 ОNа + Н 2
3. Окисление спиртов:
C 2 H 5 OH + CuO → CH 3 COH + Cu + H 2 O
(реакция идет при нагревании)
 140ºС) б) межмолекулярная: C 2 H 5 OH + НОC 2 H 5 → C 2 H 5 O - C 2 H 5 + Н 2 О (tº≤140ºС) в) Дегидратация и дегидрирование 2C 2 H 5 OH → СН 2 =СН-СН=СН 2 +Н 2 +2Н 2 О " width="640"
140ºС) б) межмолекулярная: C 2 H 5 OH + НОC 2 H 5 → C 2 H 5 O - C 2 H 5 + Н 2 О (tº≤140ºС) в) Дегидратация и дегидрирование 2C 2 H 5 OH → СН 2 =СН-СН=СН 2 +Н 2 +2Н 2 О " width="640"
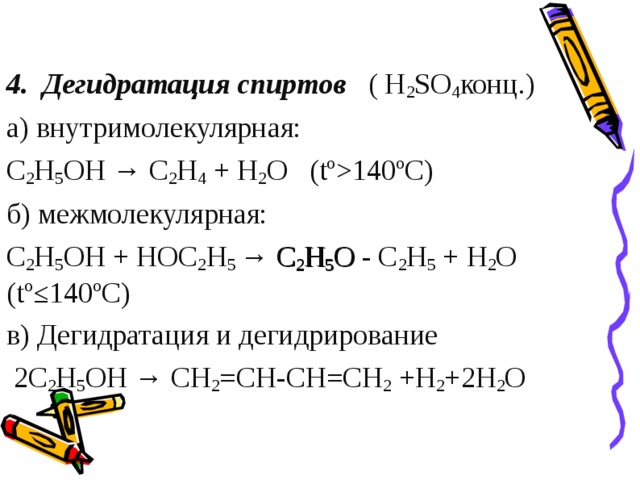
4. Дегидратация спиртов ( H 2 SO 4 конц.)
а) внутримолекулярная:
C 2 H 5 OH → C 2 H 4 + H 2 О (tº140ºС)
б) межмолекулярная:
C 2 H 5 OH + НОC 2 H 5 → C 2 H 5 O - C 2 H 5 + Н 2 О (tº≤140ºС)
в) Дегидратация и дегидрирование
2C 2 H 5 OH → СН 2 =СН-СН=СН 2 +Н 2 +2Н 2 О

3. Качественная реакция на первичные спирты!
С H 3 -CH 2 -OH + CuO 300°,Cu → CH 3 -C=O + Cu + H 2 O
│
H
(ацетальдегид – запах листвы)
Осадок CuO растворяется и образуется раствор ярко-синего цвета

ПОЛУЧЕНИЕ СПИРТОВ
1.Гидратацией алкенов
СН 2 =СН 2 + Н 2 О →СН 3 -СН 2 -ОН
- СН 2 =СН 2 + Н 2 О →СН 3 -СН 2 -ОН
2. Специфические
а)Метанола – из синтез – газа
СО+2Н 2 →СН 3 ОН
б) этанола – брожением
С 6 Н 12 О 6 →2С 2 Н 5 ОН + 2 СО 2
- С 6 Н 12 О 6 →2С 2 Н 5 ОН + 2 СО 2
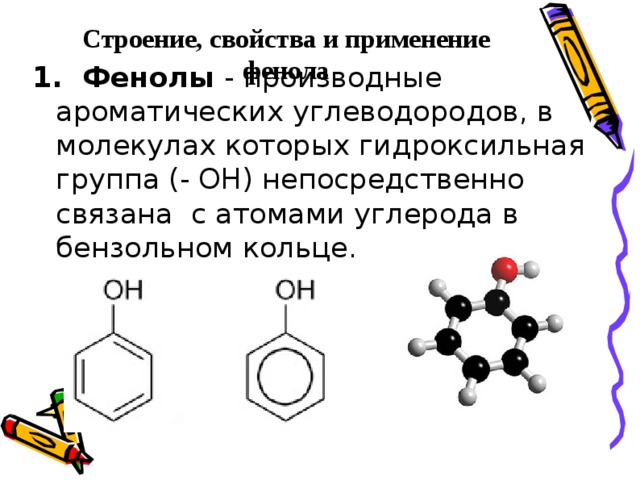
Строение, свойства и применение фенола
1. Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
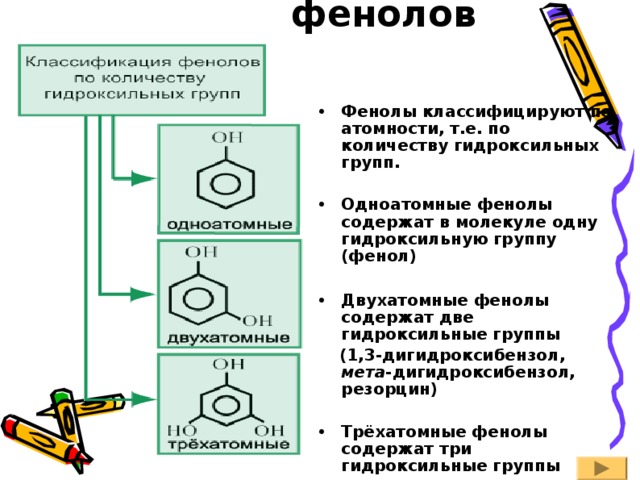
Классификация фенолов
- Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
- Одноатомные фенолы содержат в молекуле одну гидроксильную группу (фенол)
- Двухатомные фенолы содержат две гидроксильные группы
(1,3-дигидроксибензол, мета -дигидроксибензол, резорцин)
- Трёхатомные фенолы содержат три гидроксильные группы
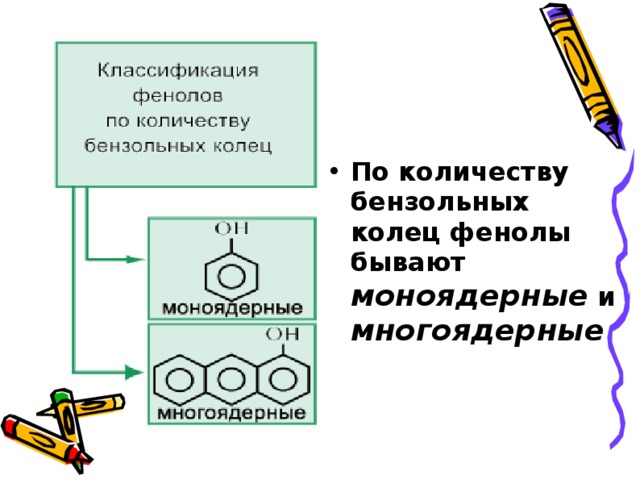
- По количеству бензольных колец фенолы бывают моноядерные и многоядерные
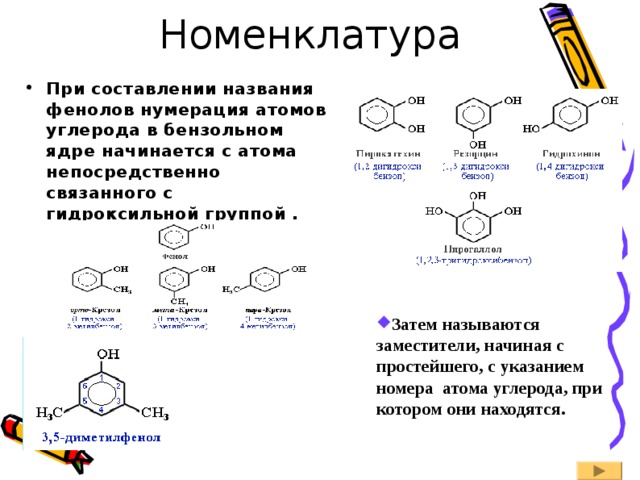
- При составлении названия фенолов нумерация атомов углерода в бензольном ядре начинается с атома непосредственно связанного с гидроксильной группой .
- Затем называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.

- Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного окисления на воздухе он бывает окрашен в розовый цвет. Его температура плавления +42 º С, температура кипения +181 º С. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 º С растворяется в любых отношениях.
- Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!

на план урока

Химические свойства фенола
- Химические свойства фенола обусловлены наличием в его молекуле
- гидроксильной группы
- бензольного ядра
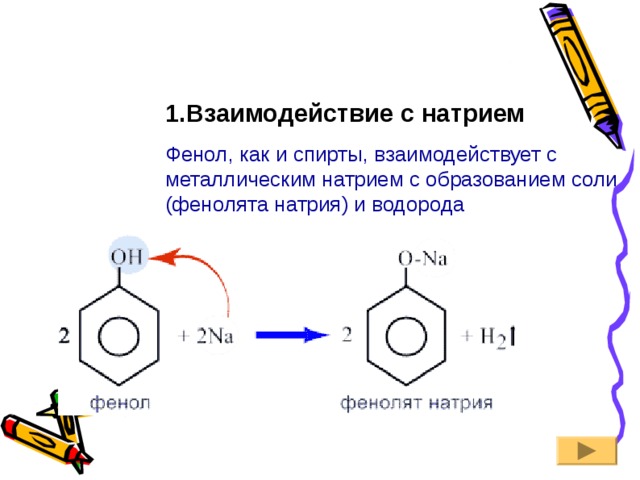
1.Взаимодействие с натрием
Фенол, как и спирты, взаимодействует с металлическим натрием с образованием соли (фенолята натрия) и водорода
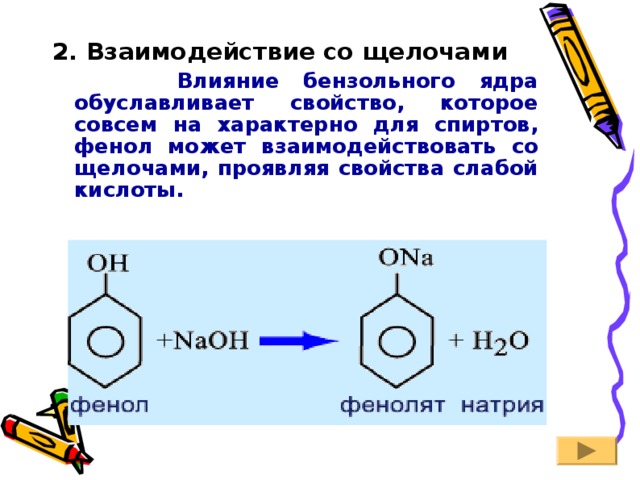
2. Взаимодействие со щелочами
Влияние бензольного ядра обуславливает свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать со щелочами, проявляя свойства слабой кислоты.

Химические свойства, обусловленные наличием бензольного ядра
Отличия от ароматических углеводородов:
1. Реакции окисления
Фенол окисляется кислородом воздуха, приобретая фиолетовую окраску.
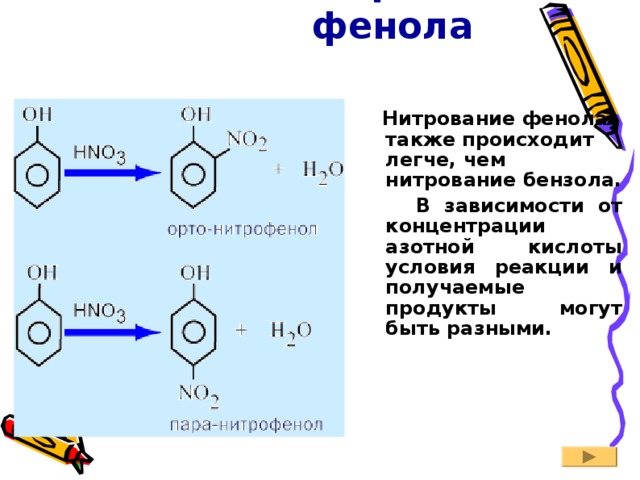
2. Нитрование фенола
Нитрование фенола также происходит легче, чем нитрование бензола.
В зависимости от концентрации азотной кислоты условия реакции и получаемые продукты могут быть разными.
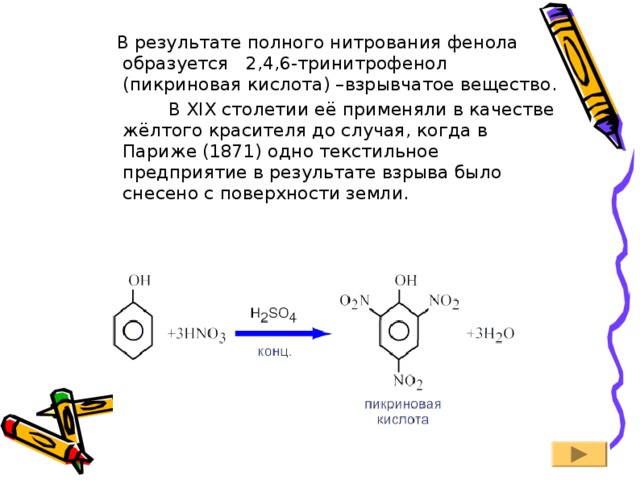
В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество.
В XIX столетии её применяли в качестве жёлтого красителя до случая, когда в Париже (1871) одно текстильное предприятие в результате взрыва было снесено с поверхности земли.
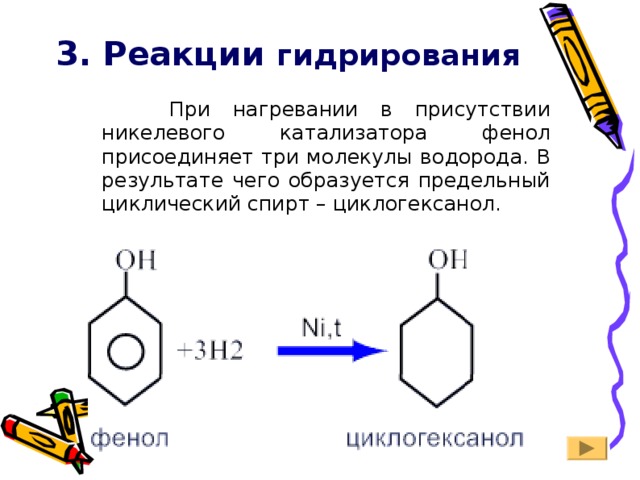
3. Реакции гидрирования
При нагревании в присутствии никелевого катализатора фенол присоединяет три молекулы водорода. В результате чего образуется предельный циклический спирт – циклогексанол.

- Фенол применяют для производства фенолформальдегидных пластмасс, синтетического волокна капролактам, красителей, лекарств, взрывчатых веществ и других продуктов. Раствор фенола в воде обладает дезинфицирующими свойствами

Чем опасен фенол.
Практически сразу после получения фенола ученые установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение непродолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом. При соприкосновении раствора фенола с кожей образуются химические ожоги, которые впоследствии трансформируются в язвы.

Сфера применения фенолов достаточно широка, но большинство жителей нашей страны узнало о них из-за скандала, разразившегося в конце 1990-х гг. вокруг печально известных «фенольных домов» – панельных многоэтажек серии П-49/П, построенных в конце 1970 – начале 1980-х гг. Эти дома в свое время считались экспериментальными. В бетон, использованный при их строительстве, добавляли фенолформальдегид. Это должно было ускорить его затвердевание и тем самым приблизить сроки сдачи домов. Новоселы, поначалу обрадовавшиеся просторным квартирам, вскоре поняли, что вместе с новым жильем они получили целый букет проблем со здоровьем – это и аллергия, и болезни глаз, почек, дыхательных путей, и даже злокачественные новообразования.
Дело в том, что фенол и его производные без труда проникают в организм человека через кожу и желудочно-кишечный тракт, а пары фенола – через легкие. В организме фенол легко образует соединения с другими веществами, присутствующими в организме. Чем выше концентрация фенола в крови, тем сильнее его неблагоприятное влияние на здоровье человека.

Симптомы отравления фенолом. Хроническое отравление фенолом угрожает не только жителям «фенольных домов». Недобросовестные изготовители мебели, строительных и отделочных материалов, лакокрасочных изделий, декоративной косметики. Помните, если вас настораживает неприятный запах недавно приобретенной вещи, если вам кажется, что ваше здоровье после покупки мебели или недавнего ремонта пошатнулось, будет лучше вызвать специалиста-эколога, который проведет все нужные исследования и даст необходимые рекомендации. Хроническое отравление фенолом вызывает поражения центральной нервной системы, нервные расстройства, сопровождаемые головными болями и потерей сознания, а также поражения почек, печени, органов дыхания и сердечно-сосудистой системы .

Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы.
Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил.
Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.

Применение фенолов























 140ºС) б) межмолекулярная: C 2 H 5 OH + НОC 2 H 5 → C 2 H 5 O - C 2 H 5 + Н 2 О (tº≤140ºС) в) Дегидратация и дегидрирование 2C 2 H 5 OH → СН 2 =СН-СН=СН 2 +Н 2 +2Н 2 О " width="640"
140ºС) б) межмолекулярная: C 2 H 5 OH + НОC 2 H 5 → C 2 H 5 O - C 2 H 5 + Н 2 О (tº≤140ºС) в) Дегидратация и дегидрирование 2C 2 H 5 OH → СН 2 =СН-СН=СН 2 +Н 2 +2Н 2 О " width="640"































