
Галогены. Общая характеристика галогенов.

История развития галогенов
Фтор
Хлор
Бром
Йод
Астат

История открытия фтора
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.
Анри Муассан
(1852 – 1907)

История открытия хлора
В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой".
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
Карл Вильгельм Шееле
(1742 – 1786)

История открытия брома
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria , означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный").
Антуан Жером Балар (1802 – 1876)

История открытия астата
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211 At они облучали висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.

Галогены на VII группе
![Периоды Ряды Группы элементов VIII VII VI III II IV V I 1 I Фтор/Fluorum (F) Внешний вид простого вещества Электронная коефигуранция Бледно-жёлтый газ. Очень ядовит . ЭО (по Полингу) [He] 2s 2 2p 5 3,98 Степень окисления Плотность − 1 Температура плавления (при −189 °C)1,108 г/см ³ 53,53К Температура кипения 85,01 К II 2 3 III IV 4 5 V 6 7 8 VI 9 VII 10](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img7.jpg)
Периоды
Ряды
Группы элементов
VIII
VII
VI
III
II
IV
V
I
1
I
Фтор/Fluorum (F)
Внешний вид простого вещества
Электронная коефигуранция
Бледно-жёлтый газ. Очень ядовит .
ЭО (по Полингу)
[He] 2s 2 2p 5
3,98
Степень окисления
Плотность
− 1
Температура плавления
(при −189 °C)1,108 г/см ³
53,53К
Температура кипения
85,01 К
II
2
3
III
IV
4
5
V
6
7
8
VI
9
VII
10
![Периоды Ряды Группы элементов VIII III I II IV V VI VII I 1 Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит . Электронная коефигуранция [Ne] 3s 2 3p 5 ЭО (по Полингу) Степень окисления 3.16 Плотность 7, 6, 5, 4, 3, 1, −1 Температура плавления (при −33.6 °C)1,56 г/см ³ Температура кипения 172.2 К 238.6 К II 2 3 III 4 IV 5 6 V 7 VI 8 9 VII 10](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img8.jpg)
Периоды
Ряды
Группы элементов
VIII
III
I
II
IV
V
VI
VII
I
1
Хлор / Chlorum (Cl)
Внешний вид простого вещества
Газ жёлто-зеленого цвета с резким запахом. Ядовит .
Электронная коефигуранция
[Ne] 3s 2 3p 5
ЭО (по Полингу)
Степень окисления
3.16
Плотность
7, 6, 5, 4, 3, 1, −1
Температура плавления
(при −33.6 °C)1,56 г/см ³
Температура кипения
172.2 К
238.6 К
II
2
3
III
4
IV
5
6
V
7
VI
8
9
VII
10
![Периоды Ряды Группы элементов VII VI II VIII IV V III I 1 I Бром / Bromum (Br) Внешний вид простого вещества Электронная конфигуранция красно-бурая жидкость с сильным неприятным запахом [Ar] 3d 10 4s 2 4p 5 ЭО (по Полингу) Степень окисления 2,96 Плотность 7, 5, 3, 1, -1 Температура плавления 3,12 г/см³ Температура кипения 265,9 К 331,9 К II 2 III 3 IV 4 5 V 6 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img9.jpg)
Периоды
Ряды
Группы элементов
VII
VI
II
VIII
IV
V
III
I
1
I
Бром / Bromum (Br)
Внешний вид простого вещества
Электронная конфигуранция
красно-бурая жидкость с сильным неприятным запахом
[Ar] 3d 10 4s 2 4p 5
ЭО (по Полингу)
Степень окисления
2,96
Плотность
7, 5, 3, 1, -1
Температура плавления
3,12 г/см³
Температура кипения
265,9 К
331,9 К
II
2
III
3
IV
4
5
V
6
7
8
VI
9
10
VII
![Периоды Ряды Группы элементов I VII V IV VIII II III VI 1 I Ио́д / Iodum (I) Внешний вид простого вещества Черно-фиолетовые кристаллы с металлическим блеском Электронная конфигуранция [Kr] 4d 10 5s 2 5p 5 ЭО (по Полингу) 2,66 Степень окисления 7, 5, 3, 1, -1 Плотность 4,93г/см³ Температура плавления 386,7 К Температура кипения 457,5 К 2 II III 3 4 IV 5 6 V 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img10.jpg)
Периоды
Ряды
Группы элементов
I
VII
V
IV
VIII
II
III
VI
1
I
Ио́д / Iodum (I)
Внешний вид простого вещества
Черно-фиолетовые кристаллы с металлическим блеском
Электронная конфигуранция
[Kr] 4d 10 5s 2 5p 5
ЭО (по Полингу)
2,66
Степень окисления
7, 5, 3, 1, -1
Плотность
4,93г/см³
Температура плавления
386,7 К
Температура кипения
457,5 К
2
II
III
3
4
IV
5
6
V
7
8
VI
9
10
VII
![Периоды Ряды Группы элементов VII VI II VIII IV V III I 1 I Аста́т / Astatium (At) Внешний вид простого вещества Электронная конфигуранция Нестабильные чёрно-синие кристаллы [Xe] 4f 14 5d 10 6s 2 6p 5 ЭО (по Полингу) Степень окисления 2,2 Плотность 7, 5, 3, 1, −1 Температура плавления n/a г/см Температура кипения 517 К 582 К II 2 III 3 IV 4 5 V 6 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img11.jpg)
Периоды
Ряды
Группы элементов
VII
VI
II
VIII
IV
V
III
I
1
I
Аста́т / Astatium (At)
Внешний вид простого вещества
Электронная конфигуранция
Нестабильные чёрно-синие кристаллы
[Xe] 4f 14 5d 10 6s 2 6p 5
ЭО (по Полингу)
Степень окисления
2,2
Плотность
7, 5, 3, 1, −1
Температура плавления
n/a г/см
Температура кипения
517 К
582 К
II
2
III
3
IV
4
5
V
6
7
8
VI
9
10
VII

С l
Кровь, желудочный сок
F
Кости, зубы
Br
Регуляция нервных процессов
I
Регуляция обмена веществ
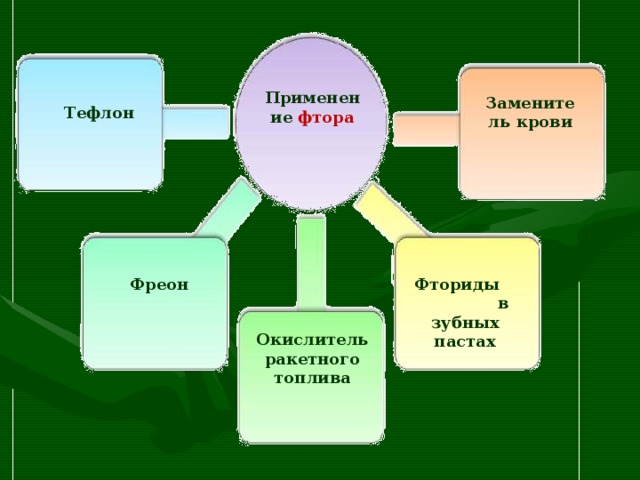
Применение фтора
Заменитель крови
Тефлон
Фториды в зубных пастах
Фреон
Окислитель ракетного топлива

Органические растворители
Дезинфекция воды
Отбеливатели
Хлорирование органических веществ
Лекарственные препараты
Применение хлора
Получение неорганических хлоридов
Получение брома, йода
Производство
HCl

Лекарственные препараты
Ветеренарные препараты
Фотография
Применение брома
Присадки к бензину
Красители
Ингибиторы

Лекарственные препараты
Дезинфекция одежды
Применение йода
Красители
Фотография
Электролампы

Физические свойства галогенов
- Фтор - светло-желтый газ, в воде не растворим, так как интенсивно с ней взаимодействует. Хлор – желто-заленый газ, раствор хлора в воде практически бесцветен - хлорная вода. Бром – бурая жидкость. Йод - с черно-фиолетовые с металлическим блеском. Кристаллический йод легко - переходит из твердого в газообразное состояние. Астат похож на йод, но имеет более ярко выраженный металлический характер. Все галогены обладают резким запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые отравления.

Химические свойства галогенов
2 Na + Cl 2 = 2 NaCl S + 3 F 2 = SF 6 2 Fe + 3 Br 2 = 2 FeBr 3 2 P + 5 Cl 2 = 2 PCl 5 2 NaI + Cl 2 = 2 NaCl + I 2 2 F 2 + 2 H 2 O = 4 HF + O 2 2 NaBr + Cl 2 = 2 NaCl + Br 2 6 KOH + 3 Cl 2 = 5 KCl + KClO 3 + 3 H 2 O

Каменная соль NaCl

Сильвинит NaCl ∙KCl

Плавиковый шпат CaF 2













![Периоды Ряды Группы элементов VIII VII VI III II IV V I 1 I Фтор/Fluorum (F) Внешний вид простого вещества Электронная коефигуранция Бледно-жёлтый газ. Очень ядовит . ЭО (по Полингу) [He] 2s 2 2p 5 3,98 Степень окисления Плотность − 1 Температура плавления (при −189 °C)1,108 г/см ³ 53,53К Температура кипения 85,01 К II 2 3 III IV 4 5 V 6 7 8 VI 9 VII 10](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img7.jpg)
![Периоды Ряды Группы элементов VIII III I II IV V VI VII I 1 Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит . Электронная коефигуранция [Ne] 3s 2 3p 5 ЭО (по Полингу) Степень окисления 3.16 Плотность 7, 6, 5, 4, 3, 1, −1 Температура плавления (при −33.6 °C)1,56 г/см ³ Температура кипения 172.2 К 238.6 К II 2 3 III 4 IV 5 6 V 7 VI 8 9 VII 10](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img8.jpg)
![Периоды Ряды Группы элементов VII VI II VIII IV V III I 1 I Бром / Bromum (Br) Внешний вид простого вещества Электронная конфигуранция красно-бурая жидкость с сильным неприятным запахом [Ar] 3d 10 4s 2 4p 5 ЭО (по Полингу) Степень окисления 2,96 Плотность 7, 5, 3, 1, -1 Температура плавления 3,12 г/см³ Температура кипения 265,9 К 331,9 К II 2 III 3 IV 4 5 V 6 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img9.jpg)
![Периоды Ряды Группы элементов I VII V IV VIII II III VI 1 I Ио́д / Iodum (I) Внешний вид простого вещества Черно-фиолетовые кристаллы с металлическим блеском Электронная конфигуранция [Kr] 4d 10 5s 2 5p 5 ЭО (по Полингу) 2,66 Степень окисления 7, 5, 3, 1, -1 Плотность 4,93г/см³ Температура плавления 386,7 К Температура кипения 457,5 К 2 II III 3 4 IV 5 6 V 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img10.jpg)
![Периоды Ряды Группы элементов VII VI II VIII IV V III I 1 I Аста́т / Astatium (At) Внешний вид простого вещества Электронная конфигуранция Нестабильные чёрно-синие кристаллы [Xe] 4f 14 5d 10 6s 2 6p 5 ЭО (по Полингу) Степень окисления 2,2 Плотность 7, 5, 3, 1, −1 Температура плавления n/a г/см Температура кипения 517 К 582 К II 2 III 3 IV 4 5 V 6 7 8 VI 9 10 VII](https://fsd.multiurok.ru/html/2018/06/11/s_5b1ed0a8bbadd/img11.jpg)




















