
ГАПОУ НСО «БАРАБИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Характеристика состояния электрона в атоме. Структура электронных оболочек
Автор: Дъячук Л.В.

Полная характеристика состояния электрона в атоме включает его энергию, размер, форму, пространственную ориентацию орбитали и направление собственного вращения электрона.

Квантовые числа
- Главное квантовое число (n) – характеризует общий запас энергии электрона или его энергетический уровень.
2) Орбитальное квантовое число (l) - число принимает значение 0(s), 1 (p), 2 (d), 3 (f). Орбитальное квантовое число зависит от главного квантового числа и принимает ряд значений, максимальное из которых равно n – 1. Орбитальное квантовое число определяет количество движения электрона и форму орбиталей. S- сферическая, p – форма восьмёрки, d – лист клевера. Формой орбитали определяется пространственное расположение атомов в молекулах.

Квантовые числа
3) Магнитное квантовое число – ml. Магнитное квантовое число связано с орбитальным, оно определяет пространственную ориентацию орбиталей. Ориентация s – орбитали однозначна, поэтому s – подуровни состоят из одной орбитали. Гантелеобразные p – орбитали ориентируются вдоль взаимоперпендекулярных направлений, таким образом существуют 3 ориентированные орбитали.
4) Спиновое квантовое число – ms. Это проекция спина.
Спин – вращение электрона вокруг собственной оси по часовой или против часовой стрелки.

Принцип Паули
- Швейцарский физик Паули в 1925 году установил, что в атоме на одной орбитали может находиться не более 2 электронов, имеющих противоположные спины.

- Все электроны в атоме находятся в разных состояниях, т.е. характеризуются разными наборами четырёх квантовых чисел.
- Если на орбитали находится один электрон, он называется неспаренным, если два, то это уже спаренные электроны, т.е. электроны с противоположными спинами.
S – орбиталь имеет сферическую форму, электрон атома водорода располагается на этой орбитали и неспарен. Его электронная формула или электронная конфигурация – 1S¹.

Строение альдегидов

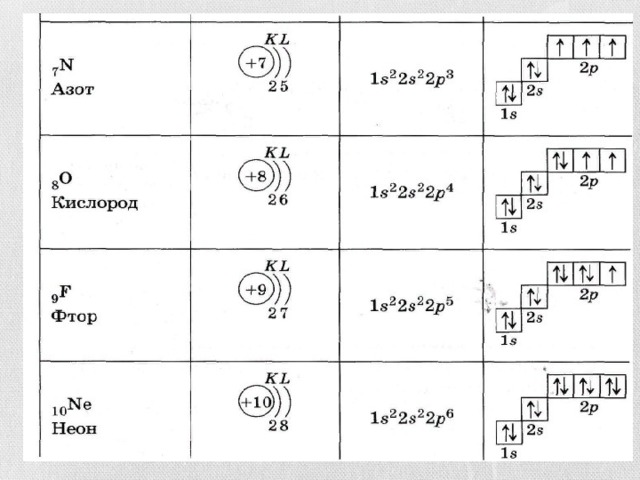
- P – орбиталь имеет форму гантели, 3 p – орбитали расположены в атоме взаимно перпендикулярно, каждый энергетический уровень, начиная со второго имеет 3 p- орбитали. У элементов второго периода сначала заполняется 2s орбиталь, а затем – 2p орбиталь.
Гомологический ряд альдегидов

- Последовательность заполнения электронами энергетических уровней следующая:
- 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 7s

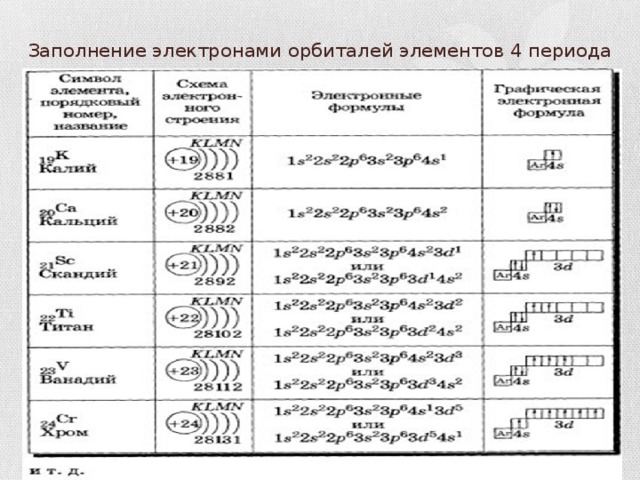
Заполнение электронами орбиталей элементов 4 периода

- s- элементы – у этих элементов электронами заполняется s- подуровень, это элементы главных подгрупп 1 и 2 групп.
- P – элементы – у них заполняется электронами p – подуровни, это элементы главных подгрупп 3-7 групп.
- D – элементы , у этих элементов заполняется d – подуровень – элементы побочных подгрупп 1-8 групп.
- f- элементы , к ним относятся лантаноиды и актиноиды.

Задание:
- 1) Составить электронные формулы для следующих химических элементов: железо, цирконий, олово
- К какой группе принадлежит каждый из этих элементов?

Ответ:


Электронное строение олова
- 1s22s22p63s23p63d104s24p64d105s25p2.

- Fe, Zr – d- элементы
- Sn – p - элемент

Задание для самоподготовки
- Повторить определения понятий: «атом», «химический элемент», «орбиталь», «главное квантовое число», «магнитное квантовое число», «орбитальное квантовое число», «спиновое квантовое число»
- Определение состава атомов (число протонов, электронов, нейтронов, заряд ядра) химических элементов
![Список использованных источников 1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с. 2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с. 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с. 4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz](https://fsd.multiurok.ru/html/2018/09/16/s_5b9de515e3a9a/img19.jpg)
Список использованных источников
- 1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
- 2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
- 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz

























![Список использованных источников 1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с. 2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с. 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с. 4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz](https://fsd.multiurok.ru/html/2018/09/16/s_5b9de515e3a9a/img19.jpg)



















