
Периодическая таблица и строение атома
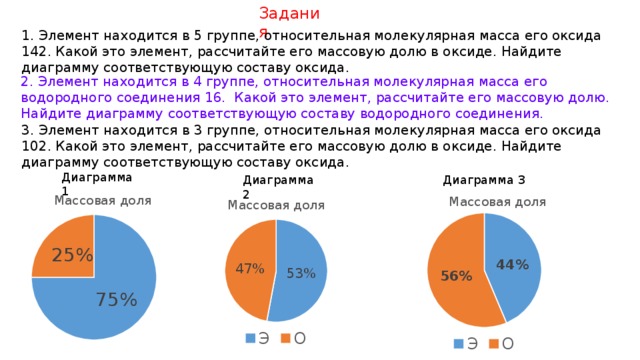
Задания
1. Элемент находится в 5 группе, относительная молекулярная масса его оксида 142. Какой это элемент, рассчитайте его массовую долю в оксиде. Найдите диаграмму соответствующую составу оксида.
2. Элемент находится в 4 группе, относительная молекулярная масса его водородного соединения 16. Какой это элемент, рассчитайте его массовую долю. Найдите диаграмму соответствующую составу водородного соединения.
3. Элемент находится в 3 группе, относительная молекулярная масса его оксида 102. Какой это элемент, рассчитайте его массовую долю в оксиде. Найдите диаграмму соответствующую составу оксида.
Диаграмма 1
Диаграмма 2
Диаграмма 3
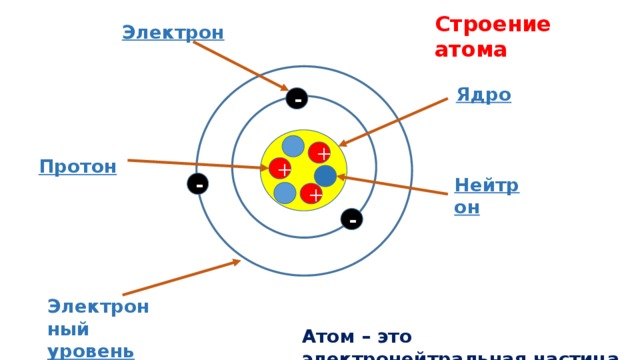
Строение атома
Электрон
Ядро
-
+
Протон
+
Нейтрон
-
+
-
Электронный уровень
Атом – это электронейтральная частица
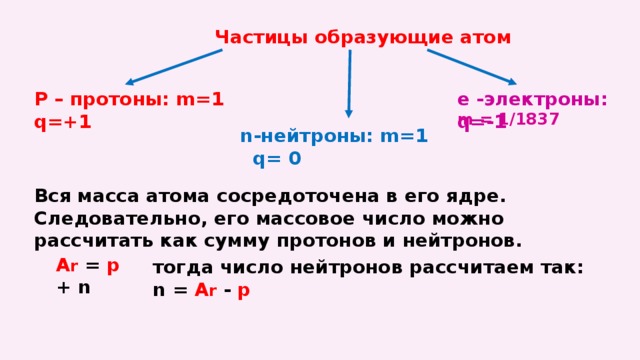
Частицы образующие атом
Р – протоны: m=1 q=+1
е -электроны: q=-1
m = 1/1837
n-нейтроны: m=1 q= 0
Вся масса атома сосредоточена в его ядре. Следовательно, его массовое число можно рассчитать как сумму протонов и нейтронов.
А r = p + n
тогда число нейтронов рассчитаем так: n = A r - p
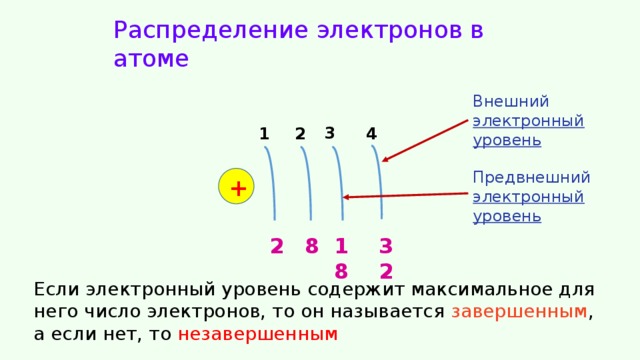
Распределение электронов в атоме
Внешний электронный уровень
3
2
1
4
Предвнешний электронный уровень
+
18
2
8
32
Если электронный уровень содержит максимальное для него число электронов, то он называется завершенным , а если нет, то незавершенным
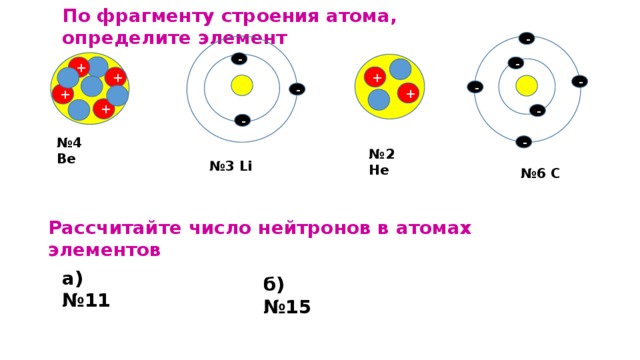
По фрагменту строения атома, определите элемент
-
-
-
+
+
+
-
-
+
-
+
+
-
-
№ 4 Ве
-
№ 2 He
№ 3 Li
№ 6 С
Рассчитайте число нейтронов в атомах элементов
а) №11
б) №15

I
II
Период начинается щелочным металлом
Вертикальные столбики табли-цы Менделеева это-периоды
Вертикальные столбики табли-
При нагревании гидроксида меди идет реакция соединения
MgO это кислотный оксид
цы Менделеева это группы
Нет
Да
Да
Нет
Нет
Да
Нет
Да
Да
Нет
б
а
Натрий – это металл
NaOH это оксид
В состав ядра атома входят протоны и нейтроны
Оксид серы(VI) – SO 3 это кислотный оксид
Кальций - неметалл
Л
и
Да
Нет
Нет
Да
Нет
Да
Да
Нет
Да
Нет
На первом электронном уровне максимум 2 электрона
СаО – это основание
Смесь соли и воды нельзя разделить выпариванием
MgO – это основание
Протон имеет заряд +1
Да
Нет
нет
да
Да
Нет
Да
Нет
Да
Нет
р
Карбонат кальция CaCO 3 – это соль
Нейтрон имеет заряд +1
Фенолфталеин в щелочах малиновый?
Период начинается галогеном
H 2 SO 4 это кислота
н
т
и
нет
да
Нет
Да
Нет
Да
Нет
Да
Нет
Да
Финиш Повторение – мать учения!
2 период, 5А группа это азот
NaOH - это основание
Финиш Повторение – мать учения!
Лакмус в растворах щелочей красный
Нет
Да
Нет
Да
да
Нет
Дальше
Дальше

Задание
Элемент находится в 6 А группе. Относительная молекулярная масса его высшего оксида 80. Определите элемент, рассчитайте массовую долю элемента в оксиде и диаграмму, которая соответствует этому оксиду
Диаграмма 1
Диаграмма 2

Связь периодической таблицы и строения атома
А.Число электронных уровней
1.Порядковый номер
№ 3 Li 2 период:
1А группа
А=7
+3 Li
Б.Заряд ядра атома
2
1
2.Номер периода
В.Общее число электронов в атоме
3.Номер группы
№ 6 С 2 период
4А группа
А = 12
Г.Число протонов в ядре атома
+6 C
4
2
Д.Число электронов на внешнем уровне
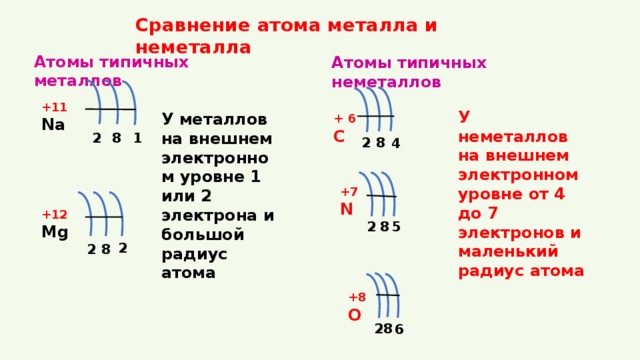
Сравнение атома металла и неметалла
Атомы типичных металлов
Атомы типичных неметаллов
+11 Na
У неметаллов на внешнем электронном уровне от 4 до 7 электронов и маленький радиус атома
+ 6 С
У металлов на внешнем электронном уровне 1 или 2 электрона и большой радиус атома
2
1
8
2
8
4
+7 N
+12 Mg
5
8
2
2
8
2
+8 O
8
2
6

Характеристика углерода
А. Положение элемента в периодической таблице
1. Порядковый номер и химический знак элемента
№ 6 С
2. Номер периода
2
3. Номер группы, подгруппа
4А ( 4 группа, главная подгруппа)
4. Атомное число
12
Б. Строение атома
1. Заряд ядра атома
+6
2.Число протонов в ядре
6
3. Общее число электронов в атоме
+ 6 С
6
4. Число нейтронов в ядре n = A - p
6
4
2
5. Число электронных уровней
2
6. Число электронов на внешнем уровне
4
В. Возможные соединения и их химический характер
1. Формула высшего оксида и его химический характер
СО 2
кислотный
2. Формула летучего водородного соединения, если оно существует
СН 4

Характеристика натрия
А. Положение элемента в периодической таблице
1. Порядковый номер и химический знак элемента
№ 11 Na
2. Номер периода
3
3. Номер группы, подгруппа
1А ( 1 группа, главная подгруппа)
4. Атомное число
23
Б. Строение атома
1. Заряд ядра атома
+11
2.Число протонов в ядре
11
+11 Na
3. Общее число электронов в атоме
11
4. Число нейтронов в ядре n = A - p
12
1
2
8
5. Число электронных уровней
3
6. Число электронов на внешнем уровне
1
В. Возможные соединения и их химический характер
1. Формула высшего оксида и его химический характер
Na 2 O
основный
2. Формула летучего водородного соединения, если оно существует
нет

План характеристики элемента
А. Положение в таблице
Порядковый номер и химический знак элемента, металл или неметалл, номер периода, номер группы и подгруппа, атомное число
Б. Строение атома
Заряд ядра атома, число протонов, общее число электронов, число нейтронов.
Число электронных уровней, число электронов на внешнем уровне
В. Возможные соединения и их химический характер
Формула высшего оксида и его химический характер ( основный, кислотный или амфотерный)
Формула основания или кислоты, которая соответствует оксиду
Формула летучего водородного соединения, если оно существует





























