
ЦЕЛЬ Для понимания и объяснения процессов, происходящих в клетке, выявить особенности строения, свойства и функции белков. На основании полученных знаний уметь проводить взаимосвязь между функциями и строением

- 1838г Жерар Мюльдер – открыл существование белковых тел и сформулировал теорию протеина
- 1888гДанилевский и Херт предложили строение белковой молекулы, но они считали, что "мономеры" представляют собой очень сложные образования - пептоны или "углеазотные комплексы".
- 1903г Фишер открыл пептидную связь и сформулировал пептидную теорию
30% Б – мыщцы
20% - в костях и сухожилиях
10% в коже
100.000 белков в организме человека

Элементарный химический состав белков
Белки, или протеины (от греч. протос – основной, первичный) занимают первое место по количеству и значению в клетке
Белки составляют 10–18%, т.е. половину сухого веса клетки.
В состав белков входят атомы С, Н, О, N, S, Р, иногда Fe, Сu, Zn.
Формула гемоглобина – C3032Н4816О872S8Fe4
Белки – это высокомолекулярные полимеры (макромолекулы )
По своей химической природе белки являются
непериодическими полимерами
Мономерами являются аминокислоты
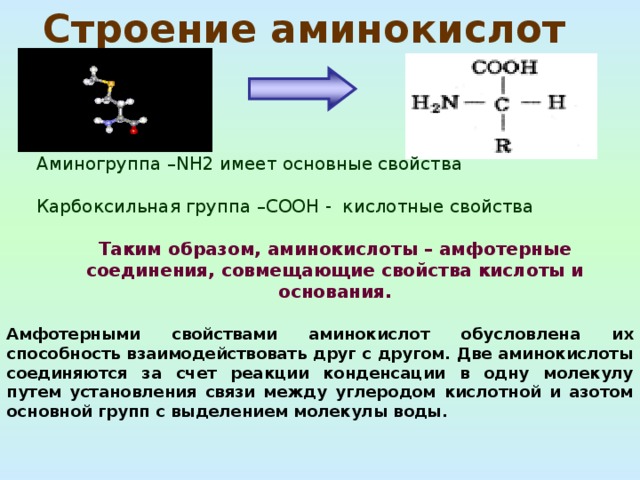
Строение аминокислот
Аминогруппа –NH2 имеет основные свойства
Карбоксильная группа –СООН - кислотные свойства
Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Амфотерными свойствами аминокислот обусловлена их способность взаимодействовать друг с другом. Две аминокислоты соединяются за счет реакции конденсации в одну молекулу путем установления связи между углеродом кислотной и азотом основной групп с выделением молекулы воды.
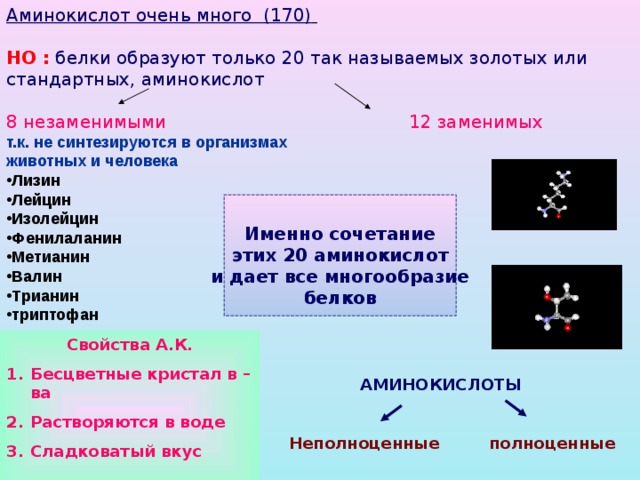
Аминокислот очень много (170)
НО : белки образуют только 20 так называемых золотых или стандартных, аминокислот
8 незаменимыми 12 заменимых
т.к. не синтезируются в организмах
животных и человека
- Лизин
- Лейцин
- Изолейцин
- Фенилаланин
- Метианин
- Валин
- Трианин
- триптофан
Именно сочетание
этих 20 аминокислот
и дает все многообразие
белков
Свойства А.К.
- Бесцветные кристал в –ва
- Растворяются в воде
- Сладковатый вкус
АМИНОКИСЛОТЫ
Неполноценные полноценные

R
R
R
+
+
HNH
HNH
C
C
NH 2
COO H
COO H
COO H
C
H
H
H
R
R
R
O
H
H
O
C
C
C
COO H
C
NH 2
N
n H2 O +
C
N
H
H
H
- C - N
O
H
D
F
T
A
S
K
G
N
G
A
S
Пептидная или амидная связь
Образование белковой молекулы
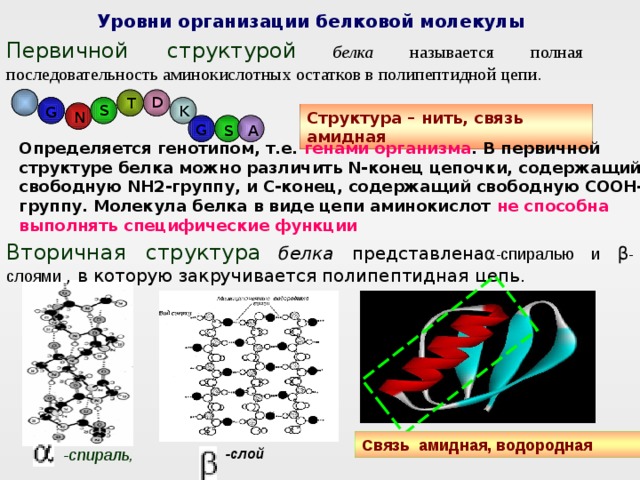
Уровни организации белковой молекулы
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи .
D
T
S
K
G
Структура – нить, связь амидная
N
G
A
S
Определяется генотипом, т.е. генами организма . В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу. Молекула белка в виде цепи аминокислот не способна выполнять специфические функции
Вторичная структура белка представлена α -спиралью и β -слоями , в которую закручивается полипептидная цепь.
Связь амидная, водородная
-спираль,
-слой
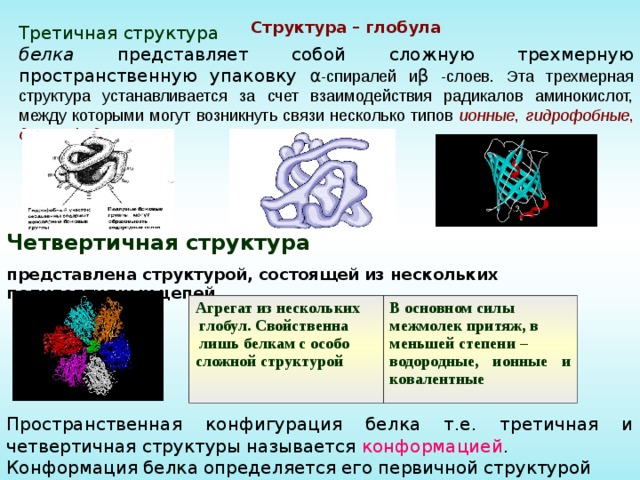
Структура – глобула
Третичная структура
белка представляет собой сложную трехмерную пространственную упаковку α -спиралей и β -слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов ионные , гидрофобные , дисульфидные :
Четвертичная структура
представлена структурой, состоящей из нескольких полипептидных цепей
Агрегат из нескольких
глобул. Свойственна
лишь белкам с особо
сложной структурой
В основном силы
межмолек притяж, в
меньшей степени –
водородные, ионные и ковалентные
Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией .
Конформация белка определяется его первичной структурой
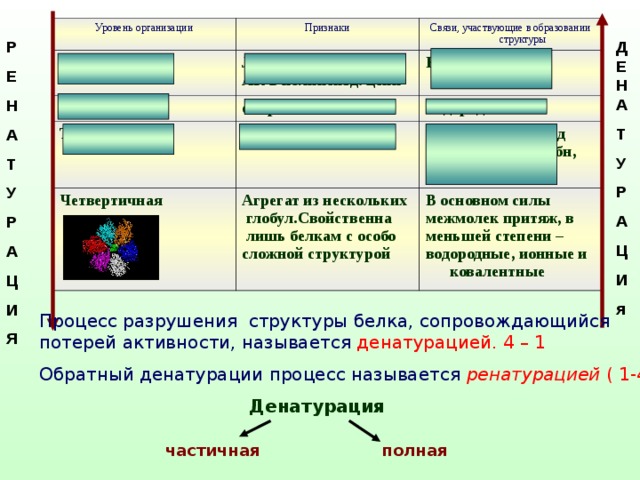
Уровень организации
Признаки
Первичная
Вторичная
Линейная последоват
АК в полипептд. цепи
Связи, участвующие в образовании структуры
спираль
Третичная
Ковалентные (пептидные)
Глобула,
Водородные
Четвертичная
Ионные,дисульфид
мостики, гидрофобн,
водородные
Агрегат из нескольких
глобул.Свойственна
лишь белкам с особо
сложной структурой
В основном силы
межмолек притяж, в
меньшей степени –
водородные, ионные и ковалентные
Р
Е
Н
А
Т
У
Р
А
Ц
И
Я
ДЕНА
Т
У
Р
А
Ц
И
я
Процесс разрушения структуры белка, сопровождающийся потерей активности, называется денатурацией. 4 – 1
Обратный денатурации процесс называется ренатурацией ( 1-4 )
Денатурация
частичная
полная

Классификация белков по составу
Сложные белки
(протеиды)
состоят из глобулярных белков и небелкового материала.
Небелковую часть называют простетической группой
- фосфопротеиды
- гликопротеиды
- нуклеопротеиды
- хромопротеиды
- липопротеиды
- металлопротеиды
Простые белки
( протеины)
состоят только из аминокислот
- Альбумины
- Глобулины
- Гистоны
- склеропротеины

Классификация белков по их структуре
Фибриллярные – образуют длинные волокна или слоистые структуры (коллаген, миозин, фиброин, кератин). Они нерастворимы в воде.
Глобулярные – их полипептидные цепи свернуты в компактные глобулы (ферменты, антитела, гормон инсулин).
Промежуточные – фибриллярной природы, но растворяются в воде (фибриноген).

Классификация белков по функциям .
Структурные – входят в различные структуры клетки и организма.
Ферменты – являются биологическими катализаторами
Гормоны – являются регуляторами биологических функций
Транспортные – переносят различные вещества.
Защитные – обеспечивают иммунные реакции организма.
Сократительные участвуют в сокращении мышечных волокон
Запасные служат резервными веществами клетки и организма.
Токсины являются ядами, используемыми живыми существами в целях защиты

Свойства белков
1. Есть белки растворимые (например, фибриноген) и нерастворимые (например, фибрин) в воде.
2. Есть белки очень устойчивые (например, кератин) и неустойчивые (например, фермент каталаза с легко изменяющейся структурой).
3. У белков встречается разнообразная форма молекул – от нитей (миозин – белок мышечных волокон) до шариков (гемоглобин) и т.д.
4 Ренатурация и денатурация
.
5. Высокий поверхностный заряд
6. Все белки строго специфичны
СПЕЦИФИЧНОСТЬ ЗАВИСИТ ОТ:
* от количества аминокислот
* от их расположения
* от конфигурации белковой молекулы
!

ФУНКЦИИ БЕЛКОВ
- Структурная (строительная). Белки входят в состав всех клеточных мембран и органоидов клетки, а также внеклеточных структур.
Например; кератин. Из этого белка состоят волосы, шерсть, рога, копыта, верхний отмерший слой кожи. В более глубоких слоях кожи расположены прокладки из белков коллагена и эластина . Именно эти белки обеспечивают прочность и упругость кожи. Они же содержатся в связках, соединяющих мышцы с суставами и суставы между собой.
2 . Ферментативная. Белки являются биологическими катализаторами. Например, пепсин, трипсин и др.
3. Двигательная . Особые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др. Так, сокращение мышц обеспечивают мышечные белки актин и миозин.
Функции
Особенности
Примеры
4. Транспортная. В крови, в наружных клеточных мембранах, в цитоплазме и ядрах клеток есть различные транспортные белки. В крови имеются белки-транспортеры, которые узнают и связывают определенные гормоны и несут их к клеткам-мишеням. Известны белки, например гемоглобин и гемоцианин , переносящие кислород, и миоглобин, удерживающий кислород в мышцах .
5. Защитная. В ответ на проникновение в организм чужеродных белков или микроорганизмов, обладающих антигенными свойствами, лимфоциты крови образуют особые белки – антитела , способные связывать и обезвреживать их. В слюне и слезах содержится белок лизоцим – фермент, разрушающий клеточные стенки бактерий. Фибрин и тромбин способствуют остановке кровотечений .
6. Энергетическая (питательная). Белки можно расщепить, окислить и получить энергию, необходимую для жизни. Правда, это не очень выгодно: энергетическая ценность белков по сравнению с жирами невысока и составляет 17,6 кДж (4,1 ккал) энергии на 1 г белка. Обычно белки расходуются на энергетические нужды в крайних случаях , когда исчерпаны запасы жиров и углеводов.

7. Регуляторная. Многие (хотя далеко не все) гормоны являются белками – например все гормоны гипофиза, гипоталамуса, поджелудочной железы (инсулин, глюкагон ) и др. Гормоны действуют на клетку, связываясь со специфическими рецепторами. Каждый рецептор узнает только один гормон.
8.Сигнальная (рецепторная). В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
9. Запасающая. Благодаря белкам в организме могут откладываться в запас некоторые вещества. Яичный альбумин служит водозапасающим белком в яичном «белке», казеин молока является источником энергии, а белок ферритин удерживает железо в яичном желтке, селезенке и печени.
10. Токсическая . Некоторые белки являются токсинами: яд кобры содержит нейротоксин
! Белки многофункциональны, так как специфичны.

ДОМАШНЕЕ ЗАДАНИЕ
- записи в тетради учить
- Приготовить устный ответ
- заполнить таблицу «Функции белков»
- Подготовиться к тесту
. Заполните пропуски в тексте: «В результате взаимодействия различных ... и образования ... связей спирализованная молекула белка образует ... структуру, которая, в свою очередь, зависит от ... структуры белка, то есть от ... аминокислот в молекуле полипептида. Субъединицы некоторых белков образуют ... структуру. Примером такого белка является ...».
УСПЕХОВ !































