
Оксиды: классификация, номенклатура, свойства, получение, применение


Оксиды - это сложные вещества,
состоящие из двух
химических элементов,
один из которых кислород,
с валентность равной 2.
Название
оксид углерода ( II ) ;
Название
оксид азота ( II );
оксид железа (III )
оксид хрома (VI )
оксид азота (V );
оксид марганца (VII)
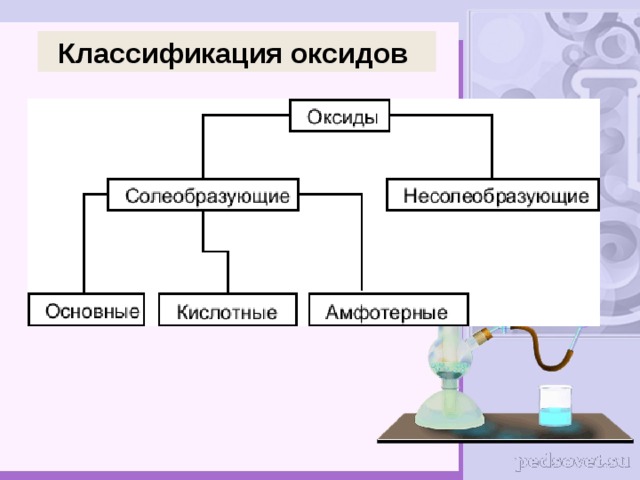
Классификация оксидов

Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия)

Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO 3 -оксид хрома (VI), Mn 2 O 7 - оксид марганца (VII))

Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III , иногда IV , а также цинк и бериллий (Например, BeO , ZnO , Al 2 O 3 , Cr 2 O 3 ).
Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O , NO , CO ).

Металлы в зависимости от валентности могут образовывать и основные, и кислотные оксиды.
Например, оксиды хрома:
CrO ( II - основный);
Cr 2 O 3 ( III - амфотерный);
CrO 3 ( VII - кислотный).
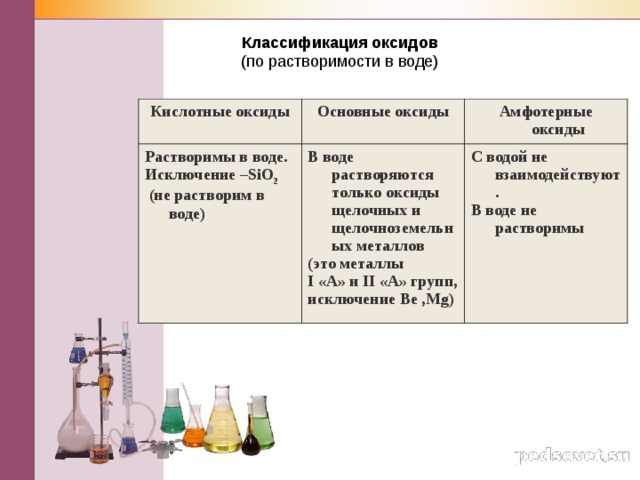
Классификация оксидов
Кислотные оксиды
Основные оксиды
Растворимы в воде.
Исключение – SiO 2
(не растворим в воде)
Амфотерные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
(это металлы
I «А» и II «А» групп,
исключение Be , Mg )
С водой не взаимодействуют.
В воде не растворимы

Физические свойства оксидов
При комнатной температуре большинство
оксидов - твердые вещества (СаО, Fe 2 O 3 , Al 2 O 3 и др.),
некоторые - жидкости (Н 2 О, Сl 2 О 7 и др.)
и газы (NO, SO 2 , СО, СО 2 и др.).

Выполните
задания
Тренажер «Классификация оксидов»

Получение оксидов
1. Горение веществ
А) простых веществ
Например:
- Горение угля в кислороде;
- Горение железа в кислороде;
- Горение фосфора в кислороде.
Б) сложных веществ

Получение оксидов
2. Разложение сложных веществ
а) солей
СaCO 3 =CaO+CO 2
б) оснований
где СaCO 3 - карбонат кальция
C а O – оксид кальция ( II )
Cu(OH) 2 =CuO+H 2 O
в) кислородсодержащих кислот
где Cu(OH) 2 - гидроксид меди ( II ),
Cu – оксид меди ( II )
H 2 SO 3 =H 2 O+SO 2
где H 2 SO 3 - сернистая кислота,
SO 2 – оксид серы ( IV )

Основной оксид + Вода = Гидроксид
Основной оксид + Кислотный оксид = Соль
Основный оксид + кислота = соль + вода

Кислотный оксид
+
Вода
=
Кислота

Амфотерный оксид
+
кислота
=
соль + вода

Лабораторная работа:
«Взаимодействие
оксидов
с кислотами»


ОКСИД ХРОМА Cr2O3
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр).

- Оксид цинка ZnO – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила).
- Цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков.
- Фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения.
- Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. .…

Сухой лед - CO 2
- Сухой лед в отличие от водяного льда плотный. Он тонет в воде, резко охлаждая ее.
- Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда.
- Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого.
- Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что проду к ты в углекислом газе не плесневеют, не гниют.

1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl 3 , K 2 O, H 2 SO 4 , SO 3 , P 2 O 5 , HNO 3 , CaO, CO.
2. Даны вещества : CaO, NaOH, CO 2 , H 2 SO3, CaCl 2 , FeCl 3 , Zn(OH) 2 , N 2 O5, Al 2 O 3 , Ca(OH) 2 , CO 2 , N 2 O, FeO, SO 3 , Na 2 SO 4 , ZnO, CaCO 3 , Mn 2 O 7 , CuO, KOH, CO, Fe(OH) 3
Выберите из перечня: основные оксиды, кислотные оксиды, безразличные оксиды, амфотерные оксиды и дайте им названия.
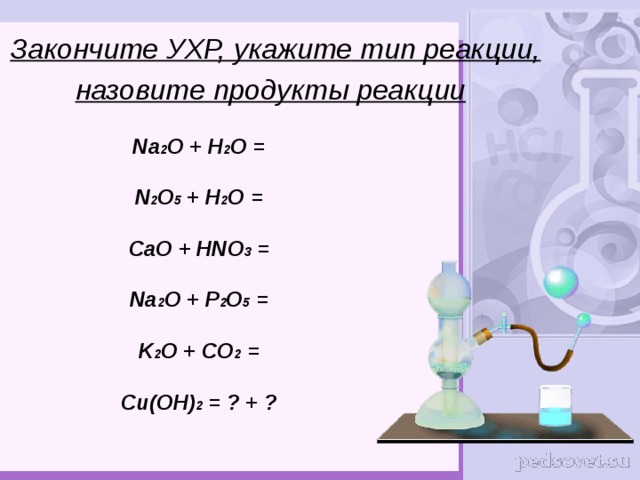
Закончите УХР, укажите тип реакции, назовите продукты реакции
Na 2 O + H 2 O =
N 2 O 5 + H 2 O =
CaO + HNO 3 =
Na 2 O + P 2 O 5 =
K 2 O + CO 2 =
Cu(OH) 2 = ? + ?

Домашнее задание
§ 30, упр. 1—7 (с. 92—93), задачи 1, 2 (с. 93).
По Хомченко: 5.1, 5.3, 5.4, 5.5, 5.6, 5.9.









































