Данная презентация предназначена для 9 класса к уроку по химии "Соединения серы".
Цель: изучить строение, свойства, получение и применение серной кислоты.
Задачи урока:
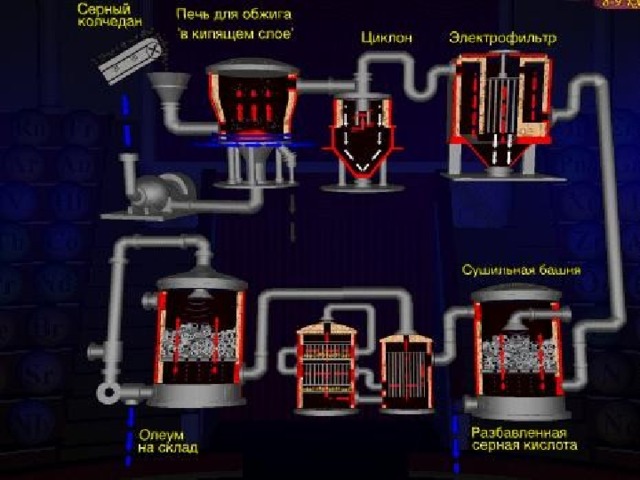
-образовательная: познакомить учащихся с физическими и химическими свойствами концентрированной и разбавленной серной кислоты; рассмотреть ее получение; показать народнохозяйственное значение этой кислоты и ее солей;
-развивающая: развитие речи, памяти, логического мышления, умений совместной деятельности; развитие и закрепление умений и навыков работы с лабораторным оборудованием;
-воспитательная: формирование мировоззрения, навыков сотрудничества;
приемственности знаний; осуществление межпредметных связей; воспитание разумного отношения к природе, экологической грамотности.
Оборудование и реактивы: коллекция минералов соединений серы, концентрированная и разбавленная серная кислота, металлический цинк, раствор сульфата меди (П), оксид меди (П), раствор гидроксида натрия, раствор хлорида бария, соли серной кислоты (медный купорос, железный купорос, безводный сернокислый натрий, гипс др.), 2 таблетки норсульфазола, индикаторы (фенолфталеин, метиловый оранжевый, лакмус), пробирки, горелка, сухое горючее, спички, лучинка, ПК, мультимедийный проектор.
Просмотр содержимого документа
«Презентация к уроку "Соединения серы"»