Просмотр содержимого документа
«презентация к уроку в 9 и 11 классах "Строение атома"»

Учитель
Козакова Елена Анатольевна
Ученики 9 «Б» класса
Волкова Нина, Карпова Елена

Модели атомов
1901 г. - Жан Перрен высказал предположение о
ядерно-планетарном строении атома

1902 г. - Уильям Томсон
(лорд Кельвин)
атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны (кексовая модель).
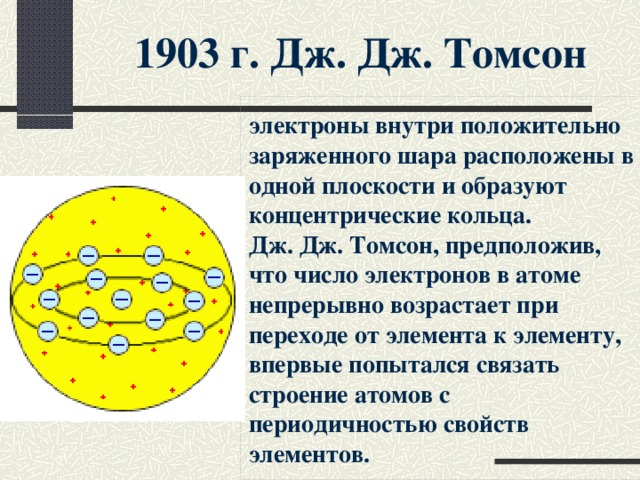
1903 г. Дж. Дж. Томсон
электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов.

1903 г. Филипп фон Ленард
(немецкий физик)
Атом состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу
1903 г. Филипп фон Ленард (немецкий физик) попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид ), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу
5

1904г. - Хантаро Нагаока
(японский физик)
атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца.

1911 г. –Эрнест Резерфорд

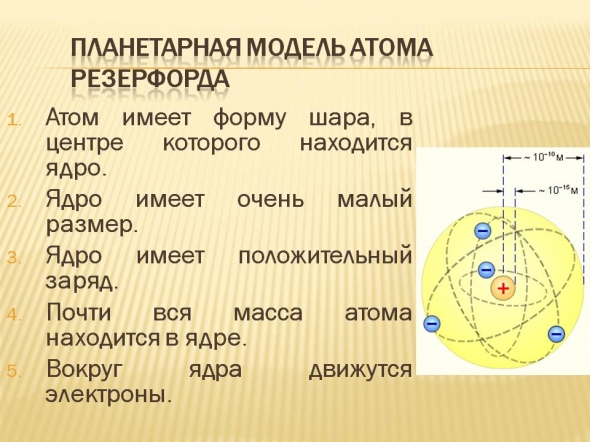
Планетарная модель атома Резерфорда
- Атом имеет форму шара, в центре которого находится ядро.
- Ядро имеет очень малый размер.
- Ядро имеет положительный заряд.
- Почти вся масса атома находится в ядре.
- Вокруг ядра движутся электроны.

Открытие протона
Э. Резерфорд - 1919 г .
Оно было сделано Резерфордом в результате бомбардировки атомов азота высоко энергетическими альфа -частицами .

Открытие нейтрона
Дж. Чедвик – 1932 г.
при облучении бериллия α - частицами обнаружено излучение , представл яющее собой поток нейтральных частиц с массой, примерно равной массе протона.

- Джеймс Чедвик доказал, что бериллиевое излучение представляет собой поток электрически нейтральных частиц, масса которых приблизительно равна массе протона. Частицы не отклонялись ни в электрическом, ни в магнитном поле.

Нейтроны
- Массу частиц удалось оценить по их взаимодействию с другими частицами. Эти частицы были названы НЕЙТРОНАМИ. Нейтрон принято обозначать символом « n ». Масса нейтрона равна 1,0086649 а.е.м., чуть больше массы протона.

Вернер Карл Гейзенберг (1901 – 1976)
- Немецкий физик-теоретик, один из основателей квантовой механики. Сформулировал в 1927 году одно из важнейших положений физики - принцип неопределенности. Дал обоснование протонно-нейтронной модели атомного ядра.

Дмитрий Дмитриевич Иваненко
(1904 – 1994)
- Протон-нейтронная модель ядра была установлена Д.Д. Иваненко в 1932 году.

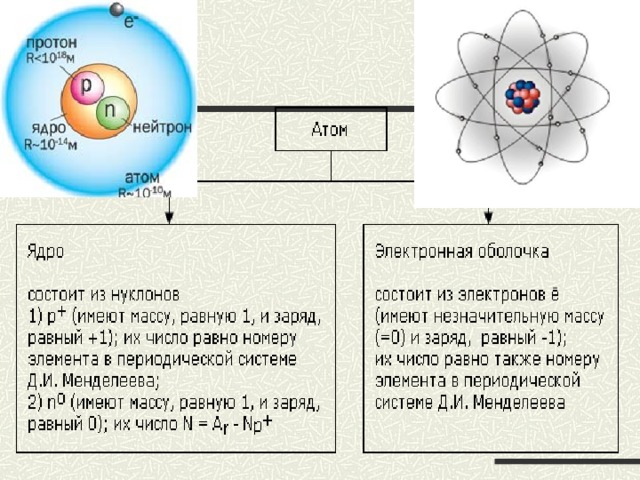
Ядро атома. Нуклоны
- Ядро состоит из протонов и нейтронов, которые имеют общее названия – нуклоны.
- Между нуклонами действуют короткодействующие силы притяжения - ядерные силы

протоны
+
ядро
нейтроны

Массовое число
- МАССОВОЕ ЧИСЛО - число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента.
А Х

Число протонов
- Число протонов в ядре атома определяет величину положительного заряда ( Z ), что является важнейшей характеристикой атома, т.к. от него зависит число электронов в атоме.
Z X

Заряд ядра
- Поэтому заряд ядра в конечном счете определяет химические свойства элемента и равен порядковому номеру элемента в периодической системе химических элементов Д.И. Менделеева.
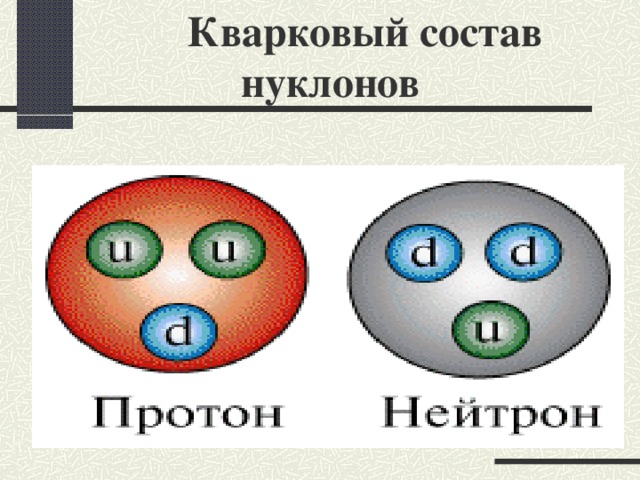
Кварковый состав нуклонов


Домашнее задание
9 класс
11 класс

§§ 56, 59 - 61

§§ 93,103,104

Спасибо за работу на уроке!