
Растворы Электролитическая диссоциация

- … у тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что необходима для жизни: ты сама жизнь.
Антуан де Сент – Экзюпери.
Планета людей.

Отличие растворов от других смесей:
Частицы, составляющие раствор, распределяются равномерно
Компоненты раствора:
- Растворитель
- Растворенные вещества
- Продукты их взаимодействия
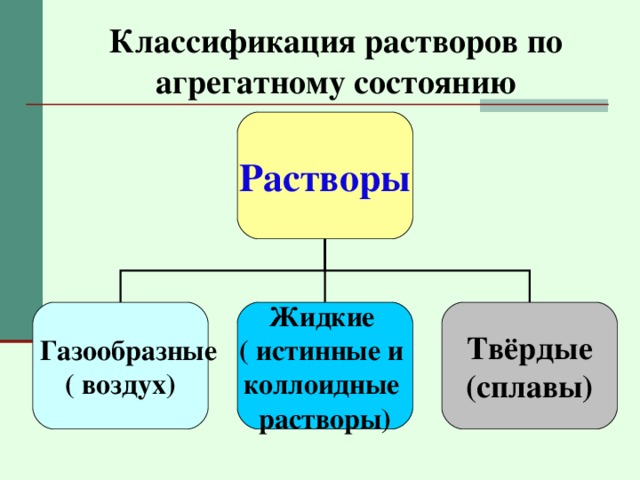
Классификация растворов по агрегатному состоянию
Растворы
Газообразные
Жидкие
( истинные и
коллоидные
растворы)
Твёрдые
(сплавы)
( воздух)

Процесс растворения
- Физический :
- Диффузия, перемешивание
- Химический:
- Выделение или поглощение тепла, изменение цвета

Современное представление о процессе растворения:
- Растворение - это физико-химический процесс. При физическом явлении разрушается кристаллическая решетка и происходит диффузия молекул растворенного вещества. При химическом явлении в процессе растворения молекулы растворенного вещества реагируют с молекулами растворителя.
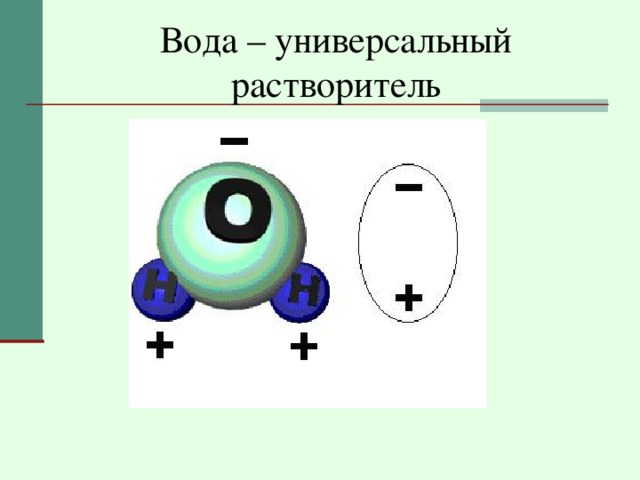
Вода – универсальный растворитель

По растворимости в воде вещества:
- Растворимые (более 1,0 г на 100 г воды)
- Малорастворимые(0,1 г - 1,0 г на 100 г воды);
- Нерастворимые (менее 0,1 г на 100 г воды).

1813 год, Лондон, Лаборатория Королевского института, Гемфри Дэви и Майкл Фарадей.
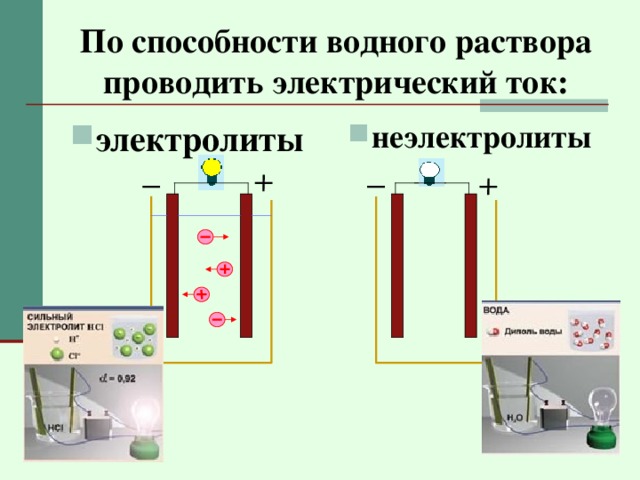
По способности водного раствора проводить электрический ток:

1889 г, Лейпциг
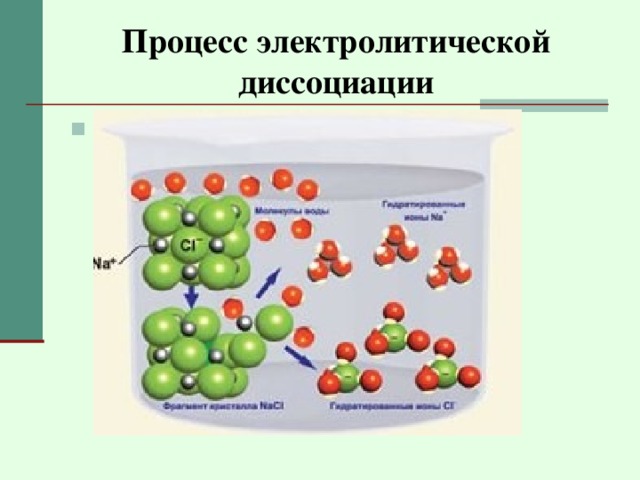
Процесс электролитической диссоциации
- Распад молекул электролита на ионы
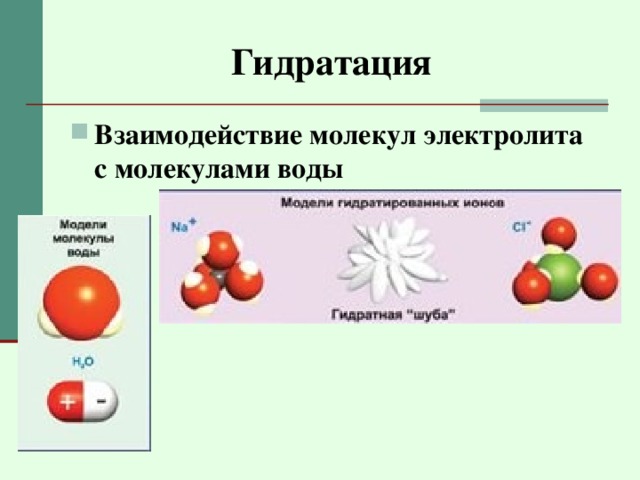
Гидратация
- Взаимодействие молекул электролита с молекулами воды

Степень диссоциации

Сильные электролиты
- Все растворимые соли
- Сильные кислоты H 2 SO 4 , HCl , HNO 3
- Все щелочи KOH , NaOH

Слабые электролиты
- Слабые кислоты H 2 S , H 2 CO 3
- Водный раствор аммиака NH 3

Ионные уравнения реакции
Реакции между ионами в растворах

Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате
- образуется осадок ( )
- образуется малодиссоциирующее вещество (например, Н 2 О)
- выделяется газ( ↑ )

Алгоритм составления ионных уравнений
1. Напишите уравнение реакции в молекулярной форме.
2. Определите причину, за счет которой реакция обмена идет до конца и отметьте это в уравнении реакции соответствующим образом ( или ↑ ).
3. Запишите ионы диссоциирующих веществ, указав их число и заряды .
4. Отметьте одинаковые ионы ( они не принимают участие в реакции ) в левой и правой частях уравнения реакции.
5. Запишите строчкой ниже оставшиеся ионы и вещества .













































