МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ № 1 ИМ. А.С. ПУШКИНА
СТ. КАВКАЗСКОЙ КАВКАЗСКОГО РАЙОНА
КРАСНОДАРСКОГО КРАЯ
ПРОГРАММА ЭЛЕКТИВНОГО КУРСА
ХИМИЧЕСКАЯ ЛАБОРАТОРИЯ ЗНАНИЙ
Автор программы:
Пономарёва Ксения Анатольевна,
учитель химии
СТ. КАВКАЗСКАЯ 2013
Пояснительная записка
Программа элективного курса «Химическая лаборатория знаний» предназначена для учащихся 10-11 классов.
Решение расчетных задач – очень важный элемент в изучении химии. Эти задачи часто вызывают большие трудности у учащихся. Содержание курса поможет учащимся получить реальный опыт решения расчётных и экспериментальных задач по химии, подготовится к сдаче единого государственного экзамена и к поступлению в вуз.
Курс нацелен на развитие умения учащихся решать задачи различными способами, способностей находить рациональное решение и применять полученные знания при решении расчётных и экспериментальных задач. Основная цель данного курса оказать помощь тем, кто изучает химию, выработать подход к решению.
Актуальность изучения курса определяется тем, что решение задач способствует развитию логического мышления, прививает навык самостоятельной работы. Данный курс обеспечивает закрепление теоретических знаний, учит применять полученные знания в различных ситуациях, адаптирует к новым требованиям в образовании. Решение сложных задач – интересный и творческий процесс, результат его часто бывает оригинальным и нестандартным, таким образом, решение задач способствует самореализации ученика.
Цель курса – расширение знаний, формирование умений и навыков у учащихся по решению расчетных и экспериментальных задач и упражнений по химии, развитие познавательной активности и самостоятельности.
Задачи курса:
закрепить умения и навыки комплексного осмысления знаний и их применению при решении задач и упражнений;
исследовать и анализировать алгоритмы решения типовых задач, находить способы решения комбинированных задач;
формировать целостное представление о применении математического аппарата при решении химических задач;
развивать у учащихся умения сравнивать, анализировать и делать выводы;
Теоретической базой служит курс химии основной школы. Расширяя и углубляя знания, полученные на уроках, учащиеся совершенствуют умения и навыки по решению расчетных и экспериментальных задач.
В процессе обучения предполагается фронтальная работа при разборе способов решения новых типов задач, групповое и самостоятельное решения задач, коллективное обсуждение решения наиболее сложных и нестандартных задач, решение расчётных и экспериментальных задач различными способами, составление учащимися оригинальных задач, работа учащихся над творческими проектами.
При решении химических задач особенно важно уметь делать расчеты по химическим формулам и уравнениям – это наиболее распространенные химические расчеты. Необходимо при взгляде на формулу вещества или уравнение реакции сразу понимать, в каких отношениях соединяются элементы или взаимодействуют вещества. Это является основой для большинства химических расчетов. Для повышения интереса к теоретическим вопросам и закрепления изученного материала, предусмотрены уроки-практикумы по составлению схем превращений, отражающих генетическую связь между классами неорганических и органических веществ, определению состава смеси, распознаванию веществ.
Неотъемлемыми условиями проведения занятий элективного курса «Химическая лаборатория знаний» является использование ИКТ и проведение проектно-исследовательской работы. Наглядность при проведении занятий, безусловно, делает материал ярче, доступнее для восприятия.
Формы контроля за уровнем достижений учащихся - текущие и итоговые контрольные работы, а также составление исследовательских проектов.
Темы исследовательских проектов:
Исследование состава питьевой воды.
Качественный состав воды из природного источника.
Способы разделения смесей.
Содержание нитратов в продуктах растительного происхождения.
По окончании курса учащиеся должны:
- знать основные формулы и законы, термины и понятия, используемые при решении задач, методы определения и разделения элементов, методы разделения смесей, правила обращения с химическим оборудованием и правила техники безопасности при работе в школьной химической лаборатории и в лаборатории промышленного предприятия;
- уметь производить измерения (массы твёрдого вещества с помощью технохимических весов, объёма раствора с помощью мерной посуды), производить расчёты по химическим формулам, производить вычисления состава растворов с использованием массовой доли растворённого вещества, молярной и нормальной концентраций, растворимости, производить расчёты по уравнениям реакций; осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета).
- владеть навыками обращения с лабораторным оборудованием, умением решать комбинированные задачи, включающие элементы типовых расчётных задач, составлять задачи самостоятельно.
Курс рассчитан на 70часов (1 час в неделю в 10 и 11 классах).
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
| № | Названия тем | Количество часов |
| 1 | Вводное занятие | 1 |
| 2 | Тема 1. Основные типы расчётных задач по химии Алгоритм решения задач. Основные химические и физические величины. | 1 |
| 3 | Тема 2. Расчёты по химическим формулам Количество вещества. Молярная масса и объём. Массовая доля элемента. Относительная плотность газов. | 10 |
| 4 | Тема 3. Растворы и способы их приготовления Процентная концентрация. Молярная и нормальная концентрации. Задачи на смешивание растворов. Объёмная доля растворённого вещества. Правило «креста». | 10 |
| 5 | Тема 4. Вычисления по уравнениям химических реакций. Определение массы (объёма) продукта реакции по известной массе (объёму) одного из реагирующих веществ. Определение выхода продукта реакции в процентах от теоретически возможного. Расчёт примесей в реагирующих веществах. Определение массы (объёма) продуктов реакции по известной массе (объёму) реагирующих веществ, одно из которых дано в избытке. | 22 |
| 6 | Тема 5. Задачи с использованием газовых законов Закон Авогадро, законы Гей-Люссака и Бойля Мариотта. Законы кратных отношений. | 5 |
| 7 | Тема 6. Решение задач алгебраическим способом | 5 |
| 8 | Тема 7. Вывод формул химических соединений различными способами Эквивалент. Эквивалентная масса. Закон эквивалентов. | 5 |
| 9 | Тема 8. Определение состава смесей Качественный анализ. Определение и разделение элементов. | 5 |
| 10 | Тема 9. Качественные задачи Распознавание веществ. Осуществление цепочки химических превращений. | 5 |
| 11 | Итоговое занятие | 1 |
| 12 | Итого | 70 |
Содержание курса
Вводное занятие (1час)
Цели и задачи курса. Планирование, подготовка и проведение химического эксперимента. Техника безопасности при проведении лабораторных и практических работ. Правила оказания первой медицинской помощи при ожогах и отравлениях химическими реактивами.
Тема 1.
Основные типы расчётных задач по химии (1 ч)
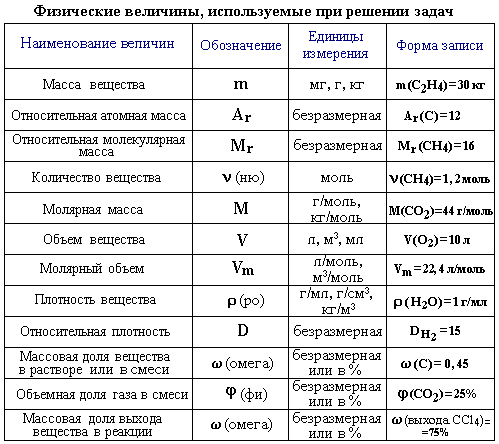
Основные химические и физические величины: масса и объём вещества, относительные атомная и молекулярная массы, плотность, относительная плотность, массовая и объёмная доли веществ в смеси, массовая и объёмная доли веществ в растворе, массовая и объёмная доли веществ выхода от теоретически возможного.
Тема 2.
Расчеты по химическим формулам (10 часов)
Основные понятия и законы химии. Вещество, химический элемент, атом, молекула. Закон сохранения массы веществ, закон постоянства состава, закон Авогадро. Количество вещества, моль, молярная масса, молярный объем газов. Массовая доля. Вычисление массовой доли химического элемента в соединении. Вывод химической формулы вещества по массовым долям элементов. Относительная плотность газов. Установление простейшей формулы вещества по массовым долям элементов с использованием абсолютной и относительной плотности вещества. Вывод формулы вещества по относительной плотности газов и массе ( объему или количеству) продуктов сгорания.
Тема 3.
Растворы и способы их приготовления (9 часов)
Постоянная Авогадро. Вычисление структурных единиц в определённом количестве, массе или объёме вещества. Уравнение Менделеева- Клайперона. Способы выражения концентрации растворов (массовая, молярная) Правило смешения растворов, («правило креста»). Кристаллогидраты.
Демонстрации. Химическая посуда для приготовления растворов (стаканы, конические и плоскодонные колбы, мерные цилиндры, мерные колбы, стеклянные палочки, стеклянные воронки и т. д.). Приготовление раствора хлорида натрия и раствора серной кислоты. Технохимические весы, разновесы. Определение объема растворов кислот и щелочей с помощью мерного цилиндра. Ареометр. Определение плотности растворов с помощью ареометра. Увеличение концентрации раствора гидроксида натрия с помощью частичного испарения воды и при добавлении дополнительного количества щелочи в раствор, проверка изменения концентрации с помощью ареометра. Уменьшение концентрации гидроксида натрия в растворе за счет его разбавления.
Практические работы. Взвешивание на технохимических весах хлорида натрия. Приготовление раствора хлорида натрия с заданной массовой долей соли в растворе. Определение объема раствора хлорида натрия с помощью мерного цилиндра и определение его плотности с помощью ареометра. Определение концентрации растворов кислот и щелочей по значениям их плотностей в таблице «Массовая доля растворенного вещества (в %) и плотность растворов кислот и оснований при 20 0 С. Смешивание растворов хлорида натрия различной концентрации и расчет массовой доли соли, и определение плотности полученного раствора.
Тема 4.
Вычисления по уравнениям химических реакций (22часа)
Химические реакции. Уравнения химических реакций. Вычисление массы(количества, объема) вещества по известной массе(количеству, объему)одного из вступивших в реакцию или получившихся веществ.
Практические работы. Определение массы оксида магния, полученного при сжигании известной массы магния. Определение массы хлорида натрия, полученного при взаимодействии раствора, содержащего известную массу гидроксида натрия, с избытком соляной кислоты.
Вычисление массовой или объемной доли выхода продукта реакции от теоретически возможного.
Практические работы. Растворение цинка в соляной кислоте и определение объема водорода. Прокаливание перманганата калия и определение объема кислорода.
Вычисление массы (объема) продукта реакции по известной массе (объему) исходного вещества , содержащего определенную массовую долю примесей.
Демонстрационный эксперимент. Растворение в воде натрия, кальция и наблюдение результатов эксперимента с целью обнаружения примесей в этих металлах.
Практическая работа. Растворение в растворе азотной кислоты порошка мела, загрязненного речным песком.
Вычисление массы (количества, объема) продукта реакции, если одно из исходных веществ дано в избытке.
Демонстрационный эксперимент. Горение серы и фосфора, определение вещества, находящегося в избытке в этих реакциях.
Практические работы. Проведение реакции между растворами азотной кислоты и гидроксида натрия, содержащими известные массы реагирующих веществ, определение избытка реагента с помощью индикатора.
Тема 5.
Задачи с использованием газовых законов (5 ч)
Закон Авогадро, законы Гей-Люссака и Бойля Мариотта. Законы кратных отношений.
Тема 6.
Решение задач алгебраическим способом (5 ч)
Использование пропорции при решении химических задач. Применение системы уравнений при решении задач.
Тема 7.
Вывод формул химических соединений различными способами (5ч)
Эквивалент. Определение эквивалентов элементов. Эквивалентная масса. Расчёт эквивалентной массы элементов и химических соединений. Закон эквивалентов. Применение закона эквивалентов при решении задач.
Тема 8.
Определение состава смесей (5 ч)
Проведение реакции смеси двух веществ с реактивом, взаимодействующим только с одним компонентом смеси. Проведение реакции смеси двух веществ с реактивом, взаимодействующим со всеми компонентами смеси. Обсуждение результатов эксперимента. Решение задач на определение состава смесей. Методы обнаружения и разделения элементов.
Демонстрационный эксперимент. Взаимодействие смеси цинковой пыли и медных опилок с соляной кислотой. Взаимодействие смеси порошка магния и цинковой пыли с соляной кислотой.
Практические работы. Определение катионов и анионов в различных смесях.
Тема 9.
Качественные задачи (5 ч)
Понятие качественной реакции. Определение веществ с помощью таблицы растворимости кислот, оснований и солей, характеристика видимых изменений процессов. Определение неорганических веществ, находящихся в разных склянках без этикеток, без использования дополнительных реактивов. Осуществление превращений неорганических веществ.
Демонстрационный эксперимент. Идентификация растворов сульфата железа (II), сульфата меди (II), хлорида алюминия, нитрата серебра с помощью раствора гидроксида натрия. Идентификация растворов хлорида натрия, иодида калия, фосфата натрия, нитрата кальция с помощью раствора нитрата серебра и азотной кислоты.
Осуществление цепочки превращений: натрий – гидроксид натрия – сульфат натрия – хлорид натрия – хлорид серебра.
Практические работы. Определение в пронумерованных склянках без этикеток растворов карбоната натрия, хлорида бария, растворов соляной и серной кислот без использования дополнительных реактивов. Осуществление цепочки превращений: магний – оксид магния – нитрат магния – гидроксид магния – сульфат магния.
Итоговое занятие (1 ч)
Выполнение итоговой контрольной работы, представление проектов, обсуждение результатов обучения по курсу «Лаборатория химических знаний».
В результате изучения элективного предмета ученик должен
Знать/понимать
Важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, объем вещества, моль, молярная масса, молярный объем газа, относительные атомная и молекулярная массы, плотность, относительная плотность газа, массовая и объемная доли веществ в смеси, массовая и объемная доли веществ в растворе, массовая и объемная доли веществ выхода от теоретически возможного, мольная доля вещества.
Основные законы химии: закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро, закон Гесса, законы Гей-Люссака и Бойля Мариотта, законы кратных отношений.
Уметь
Называть: изученные вещества по «тривиальной» и международной номенклатуре;
Определять: валентность и степень окисления химических элементов, характер среды в водных растворах, направление смещения равновесия под влиянием различных факторов;
Осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета).
УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ:
1. О.С.Габриелян, Ф.Н.Маскаев, С.Ю.Пономарев, В.И.Теренин «Химия 10» ООО Дрофа 2000; 2005.
2. И.Г. Хомченко «Решение задач по химии». – М.: ООО «Издательство Новая Волна», 2004.
3. О.С.Габриелян И.Г.Остроумов «Настольная книга учителя химии 10 кл.» М Блик и К 2001.
4. О.С.Габриелян, И.Г.Остроумов «Химия» методическое пособие М., Дрофа, 2006.
5. Иванова Р.Г., Каверина Н.А., Корощенко А.С. «Вопросы, упражнения и задания по химии 10-11» М., Просвещение, 2004.
6. О.С.Габриелян, С.Ю.Пономарева, Карцева «Органическая химия: задачи и упражнения» М., Просвещение, 2006.
7. Р.И.Иванова, А.А.Каверина, А.С.Корощенко «Контроль знаний учащихся по химии 10-11 класса» М., Дрофа, 2006.
8. Н.С.Павлова «Дидактические карточки-задания по химии» 10 класс М., Экзамен 2006.
9. Новошинский Н.Н. «Типы химических задач и способы их решения» М. «Оникс 21 век» 2005.
10. Маршанова Г.Л. «Сборник задач по органической химии. 10-11 классы» - М. «Издат-школа 2000» 2005.
11.В.А.Болотов, «ЕГЭ химия 2005-2009» М., Просвещение, 2009.
12.А.А.Каверина и др., «Учебно – тренировочные материалы для подготовки к ЕГЭ» М., Интеллект - Центр, 2005.
13.Материалы ЕГЭ 2005 – 2011 года.
14.Р.А.Лидин, В.Б.Маргулис, Н.Н.Потапова «Химия для школьников и абитуриентов. Химические задачи с решениями» М., «Просвещение» 2004
14.А.С.Корощенко, М.Г.Снастина « Реальные варианты ЕГЭ 2008 – 2009».
М.:АСТ: Астрель, 2007. ФИПИ.
15. электронные пособия:
СD диски «Общая и неорганическая химия»,
«Органическая химия»
«Виртуальная лаборатория»
Интернет-ресурсы:
http://www.chem-astu.ru/chair/study/genchem/index.html
http://bril2002.narod.ru/chemistry.html
http://www.chemel.ru/
http://www.prosv.ru/ebooks/Gara_Uroki-himii_8kl/index.html
http://chem-inf.narod.ru/inorg/element.html
ПРИЛОЖЕНИЕ
(примеры разработок, задач с решениями, практических работ по темам)
Тема 1.
Основные типы расчётных задач по химии
Алгоритм решения задач. Основные физические величины.
Чтобы решить химическую задачу рекомендуется следующий порядок действий.
Изучите внимательно условия задачи: определите, с какими величинами предстоит проводить вычисления, обозначьте их буквами, установите единицы их измерения, числовые значения, определите, какая величина является искомой. Запишите данные задачи в виде кратких условий.
Если в условиях задачи идет речь о взаимодействии веществ, запишите уравнение реакции (реакций) и уравняйте его (их) коэффициентами.
Выясните количественные соотношения между данными задачи и искомой величиной. Для этого расчлените свои действия на этапы, начав с вопроса задачи, выяснения закономерности, с помощью которой можно определить искомую величину на последнем этапе вычислений. Если в исходных данных не хватает каких-либо величин, подумайте, как их можно вычислить, т.е. определите предварительные этапы расчета. Этих этапов может быть несколько.
Определите последовательность всех этапов решения задачи, запишите необходимые формулы расчетов.
Подставьте соответствующие числовые значения величин, проверьте их размерности, произведите вычисления.
Тема 2.
Расчёты по химическим формулам
Виды задач с использованием химической формулы
| Вид задачи
| Примеры |
| 1. Расчет относительной молекулярной массы (Mr) | 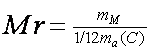
Mr = Ar(Э1)×n1 + Ar(Э2)×n2+…
|
| 2. Вычисление массовых отношений элементов | 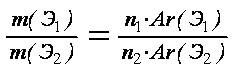
|
| 3. Вычисление массовых долей элементов (W) | 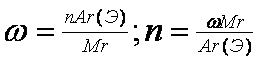
|
| Вид задачи
| Примеры |
| 4. Расчеты с использованием понятия «количество вещества»:
расчет числа структурных частиц (молекул, атомов) в определенном количестве вещества |
m = n * M;
V = n * Vm;
N = n * NA |
| 5. Вычисление относительной плотности газов | 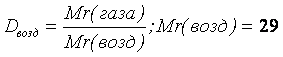
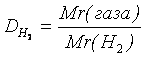
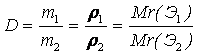
|
Тема 3.
Растворы и способы их приготовления
Задача 1. В 1630 году немецкий химик Иоганн-Рудольф Глаубер, изучая состав воды минерального источника вблизи Нойштадта, открыл лечебные свойства мирабилита - кристаллогидрата сульфата натрия состава Na2SO4 . 10H2O. Это вещество, получившее название "глауберова соль", врачи-практики успешно применяли более 300 лет как дешевое и безвредное слабительное средство. Кроме того, мирабилит в большом количестве применяется в стекловарении и других областях промышленности. Рассчитайте массу воды и безводного сульфата натрия, содержащихся в 322 кг Na2SO4 *10H2O.
Решение: Запишем условие задачи в формульном виде:
m (Na2SO4 * 10H2O) = 322 кг; M (H2O) = 18 г/моль; n (кр.H2O) = 10;
M (Na2SO4) = 142 г/моль; M(Na2SO4 * 10H2O) = 322 г/моль
m (кр. H2O) = ?; m (кр. Na2SO4) = ?
В решении задачи используется соотношение:
m (кр. H2O) = m Na2SO4 * 10H2O) * n (кр. H2O) * (M (H2O) / M (Na2SO4 * 10H2O) = 322 * 10 * 18 / 322 = 180 кг
m (кр. Na2SO4) = m (кр) * M (Na2SO4) / M (Na2SO4 * 10H2O) = 322 * 142 / 322 = 142 кг
Ответ. 180 кг H2O и 142 кг Na2SO4
Задача 2. Если растения (например, помидоры) в теплице были поражены фитофторозом, то рекомендуется после сбора урожая и удаления ботвы с грядок обработать землю 1,5%-ным (в расчете на безводную соль) раствором сульфата меди (II). Какая масса кристаллогидрата состава CuSO4 * 5H2O требуется для приготовления 100 л такого раствора? Плотность 1,5%-ного раствора CuSO4 равна 1014 г/л.
Решение: Запишем условие задачи в формульном виде:
V1 = 100 л;
ρ1 = 1014 г/л;
M(CuSO4 * 5H2O) = 250 г/моль;
M(CuSO4) = 160 г/моль;
ω (CuSO4) = 1,5% = 0,015
m(CuSO4 * 5H2O) = ?
В решении задачи используется соотношение:
m(CuSO4 * 5H2O) = m(CuSO4) . M(CuSO4 * 5H2O) / M(CuSO4) =
= ω (CuSO4) . ρ1 . V1 . M(CuSO4 * 5H2O) / M(CuSO4) =
= 0,015 . 1014 . 100 . 250 / 160 = 2376 г = 2,376 кг
Ответ: 2,376 кг CuSO4 * 5H2O
Задача 3. какие массы 96 %-ного и 40 %-ного растворов серной кислоты потребуются для приготовления 1 кг 70 %-ного раствора серной кислоты, применяемого для заполнения кислотных аккумуляторов?
Решение:
Эту задачу легче всего решать, используя так называемое «правило креста», или «квадрат Пирсона».
Для этого записывают одно под другим значения массовых долей исходных растворов, а в точке пересечения диагоналей квадрата записывают значение искомой массовой доли:
9 6 %
6 %
7 0 %
0 %
40 %
Затем определяют разности между исходными и искомым значениями массовых долей и записывают результаты на дальней стороне квадрата:
9
 6 % 30
6 % 30
7
 0 %
0 %
40 % 26
Эти числовые результаты и есть массовые части исходных растворов: для приготовления 70%-ного раствора H2SO4 необходимо взять 30 весовых (массовых) частей 96%-ного раствора H2SO4 и 26 весовых частей 40%-ного раствора H2SO4.
По условию задачи необходимо приготовить 1 кг (1000 г) 70%-ного раствора H2SO4. Всего весовых частей исходных растворов 30+ 26 = 56 (частей). Это соответствует 1000 г раствора. Отсюда рассчитываем массы исходных растворов:
m (96 %-ного раствора) = 1000 * 30 /56 = 535,7 г
m (40 %-ного раствора) = 1000 * 26 /56 = 464,3 г
Ответ: 535,7 г 96%-ного раствора и 464,3 г 40%-ного раствора H2SO4
Тема 4.
Вычисления по уравнения химических реакций
Определение массы (объёма) продукта реакции по известной массе (объёму) одного из реагирующих веществ
Алгоритм решения задач по химическим уравнениям.


Задача 1. К 20 г карбоната кальция прибавлен избыток соляной кислоты. Выделившийся при этом газ пропущен через избыток баритовой воды (Ba(OH)2). Вычислите массу образовавшегося при этом осадка.
Решение:
Запишем уравнение протекающих реакций:
CaCO3 + 2 HCl = CaCl2 + H2O +CO2 (1)
CO2+ Ba(OH)2 = BaCO3 + H2O (2)
M (CaCO3) = 100 г /моль
n (CaCO3) = m / M = 20г / 100г/моль = 0,2 моль
По уравнению реакции (1):
n (CO2) = n (CaCO3) = 0,2 моль
По уравнению реакции (2):
n (BaCO3) = n (CO2) = 0,2 моль
m = n * M
Mr (BaCO3) = 137 + 12+ 16 * 3 = 197
M (BaCO3) = 197 г/моль
m (BaCO3) = 197 г/моль * 0,2 моль = 39,4 г
Ответ: 39,4 г
Определение выхода продукта реакции в процентах от теоретически возможного
Пример практической работы
ОПРЕДЕЛЕНИЕ ОБЪЕМА ВЫДЕЛИВШЕГОСЯ ГАЗА
Оборудование и реактивы: аппарат Кирюшкина, мерный цилиндр (100 мл), кристаллизатор, весы с разновесами; цинк (гранулы), раствор соляной кислоты (1: 1).
Ход работы.
Взвесьте выданную вам гранулу цинка. Рассчитайте объем водорода, который может быть получен при растворении этой навески цинка в соляной кислоте (теоретически возможный объем водорода). Масса одной гранулы цинка обычно 0,4 — 0,7 г, т. е. в результате реакции может выделиться водород объемом до 240 мл. Растворение гранулы происходит долго, и выбор мерной посуды для собирания водорода тоже становится проблемой. Поэтому каждую гранулу нужно разделить на 3 — 4 части с помощью кусачек и взвесить весь цинк, который выдается учащимся.
Соберите прибор для получения газов и проверьте его на герметичность. Поместите навеску цинка в пробирку с газоотводной трубкой. Прилейте соляную кислоту. Газоотводную трубку прибора быстро подведите к отверстию мерного цилиндра, наполненного водой и опрокинутого в кристаллизатор с водой. Подождите до полного окончания растворения цинка. Не вынимая мерного сосуда из воды, определите объем собранного водорода (практический объем водорода). Объемы водорода, собранные каждым учеником, сложить и определить выход газа (в процентах) от теоретически возможного по формуле:
ω = V (H2)практ. / V (H2)теор.
Обязательно обсуждаются причины отличия практического и теоретического значений объемов газов.
Расчет примесей в реагирующих веществах.
Задача 1. При прокаливании 400 г натриевой селитры получили 33,6 л кислорода. Какова массовая доля примесей в селитре?
Решение:
Находим чистую массу нитрата натрия (натриевой селитры):
Пишем уравнение реакции, подставляем сверху объем кислорода, снизу данные согласно уравнению:
x г 33,6 л
2NaNO3 = 2NaNO2 + O2↑
170 г 22,4 л
Mr(NaNO3) = 23 + 14 + 16 * 3 = 85
M(NaNO3) = 85 г/моль
m(NaNO3) = M * n = 85 г/моль * 2 моль = 170 г
V(O2) = 22,4 л/моль * 1 моль = 22,4 л
Составляем пропорцию:
x г – 33,6 л
170 г – 22,4 л
х = 170 г * 33,6 л / 22,4 л = 255 г
Находим массу примесей:
m(прим.) = 400 г – 255 г = 145 г
Находим массовую долю примесей:
ω = 145г / 400 г = 0,36 или 36%
Ответ: 36 %
Задача 2.Сколько литров углекислого газа можно получить из 119 г известняка, содержащего 16 % примесей?
Решение:
Находим массовую долю карбоната кальция в известняке:
ω (CaCO3) = 100% – 16% = 84%
Находим чистую массу карбоната кальция:
m(CaCO3) = 119 г *0,84 = 100 г
Пишем уравнение реакции, подставляем сверху данные по условию задачи, снизу данные согласно уравнению:
100 г x л
CaCO3 = CaO + CO2↑
100 г 22,4 л
Mr (CaCO3) = 40 + 12 + 16 * 3 = 100
M (CaCO3) = 100 г/моль
m(CaCO3) = M * n = 100 г/моль * 1 моль = 100 г
v(CO2) = 22,4 л/моль * 1 моль = 22,4 л
Составляем пропорцию:
100 г – x л
100 г – 22,4 л
х = 22,4 л
Ответ: 22,4 л
Определение массы одного из продуктов реакции по известным массам реагирующих веществ, одно из которых дано в избытке
Задача 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение:
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Mr (K2O) = 2*39 + 16 = 94,
Mr (HNO3) = 1 + 14 + 3*16 = 63,
M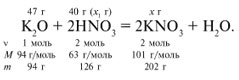 r (KNO3) = 39 + 14 + 3*16 = 101.
r (KNO3) = 39 + 14 + 3*16 = 101.
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
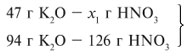
47/94 = х1/126,
х1 = 63 г.
С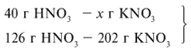 ледовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ледовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
40/126 = х/202,
х = 64 г.
Ответ. m (КNO3) = 64 г.
Задача 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
Решение:
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Mr(HCl) = 1 + 35,5 = 36,5,
M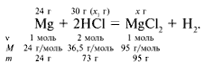 r(MgCl2) = 24 + 2•35,5 = 95.
r(MgCl2) = 24 + 2•35,5 = 95.
Д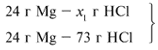 ля удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
ля удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
24/24 = х1/73,
х1 = 73 г.
И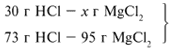 з расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:
з расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:
30/73 = х/95,
х = 39 г.
Ответ. m (MgCl2) = 39 г.
Тема 5.
Задачи с использованием газовых законов
Примерные вопросы теста на итоговом занятии:
1. Объем данного количества газа при постоянной температуре обратно пропорционален его давлению.
закон Шарля
закон Бойля-Мариотта
закон Гей-Люссака
закон Дальтона
затрудняюсь ответить
2. При постоянном давлении, для постоянной массы идеального газа справедлив закон:
закон Шарля
закон Бойля-Мариотта
закон Гей-Люссака
закон Дальтона
затрудняюсь ответить
3. Три макропараметра (давление, объем и температура) для 1 моля вещества связаны законом:
Шарля
Бойля-Мариотта
Менделеева-Клапейрона
Клапейрона
затрудняюсь ответить
4. Для смеси химически не взаимодействующих газов, для определении их общего объема применим закон:
закон Шарля
закон Бойля-Мариотта
закон Гей-Люссака
закон Дальтона
затрудняюсь ответить
5. В замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующих в теплообмене, равна нулю. Это формулировка:
первого закона термодинамики
второго закона термодинамики
третьего закона термодинамики
уравнения теплового баланса
затрудняюсь ответить
6. Количество теплоты, сообщенное системе, расходуется на увеличение ее внутренней энергии и на работу, совершаемую системой против внешних сил. Это формулировка:
первого закона термодинамики
второго закона термодинамики
третьего закона термодинамики
уравнения теплового баланса
затрудняюсь ответить
7. Изменение внутренней энергии системы равно сумме сообщенного ей количества теплоты и работы, произведенной над системой внешними силами. Это формулировка:
первого закона термодинамики
второго закона термодинамики
третьего закона термодинамики
уравнения теплового баланса
затрудняюсь ответить
8. В природе невозможен такой циклический процесс, единственным результатом которого было бы превращение теплоты, получаемой системой от нагревателя или окружающей среды в работу. Это формулировка:
первого закона термодинамики
второго закона термодинамики
третьего закона термодинамики
уравнения теплового баланса
затрудняюсь ответить
9. Из всех циклических процессов в термодинамике, идущих при данной минимальной и максимальной температурах, наибольшим коэффициентом полезного действия обладает цикл Карно. Это формулировка:
первая теорема Карно
вторая теорема Карно
третий закон термодинамики
первый закон термодинамики
затрудняюсь ответить
10. Третьему началу термодинамики соответствует следующая формулировка:
Изменение внутренней энергии системы равно сумме сообщенного ей количества теплоты и работы, произведенной над системой внешними силами.
Из всех циклических процессов в термодинамике, идущих при данной минимальной и максимальной температурах, наибольшим коэффициентом полезного действия обладает цикл Карно.
Количество теплоты, сообщенное системе, расходуется на увеличение ее внутренней энергии и на работу, совершаемую системой против внешних сил.
Абсолютный нуль температуры недостижим; к нему можно лишь асимптотически приближаться.
Затрудняюсь ответить
Ключ:
| № вопроса | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ответа | 2 | 3 | 4 | 4 | 4 | 1 | 1 | 2 | 2 | 4 |
Тема 6.
Решение задач алгебраическим способом
Задача 1. При полном гидролизе 2,64 г сложного эфира образовалось 1,8 г карбоновой кислоты и 1,38 г спирта. Определите молекулярную формулу сложного эфира.
Решение:
2,64 г 1,8 г 1,38 г
CnH2n+1COOCmH2m+1 + H2O = CnH2n+1COOH + CmH2m+1OH
14n +14m + 46 14n + 46 14m + 18
Задачу решаем при помощи системы уравнений:
2 ,64 = 1,8
,64 = 1,8
14n +14m + 46 14n + 46
1,8 = 1,38
14n + 46 14m + 18
25,2 m + 32,4 = 19,32 n + 63,48
m = (19,32 n + 31,08) / 25,2 = 0,77 n + 1,23
2,64 (14n + 46) = 1,8 (14 n + 14 (0,77 n + 1,23) + 46
36,96 n + 121,44 = 25,2 n + 19,4 n + 31 + 82,2
7,64 n = 7,64
n = 1
m = 0,77 n + 1,23 = 2
CH3COOC2H5
Ответ: CH3COOC2H5 – этиловый эфир уксусной кислоты.
Тема 7.
Вывод формул химических соединений различными
способами
Задача 1. Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,3 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Решение:
Расчёт ведём на 100г соединения. Тогда масса углерода равна 9,97 г; водорода – 6,73 г; кислорода – 53,3 г.
Определяем количество вещества:
n (С) = 39,97г /12 г/моль = 3,33 моль
n (Н) = 6,73г./ 1,008 г/моль = 6,66 моль
n (О) = 53,3г./ 16 г/моль = 3,33 моль
Делим на наименьшее число – 3,33.
n (С) : n (Н) : n (0) = 1 : 2 : 1
Простейшая формула соединения – CH2О
М (CH2О) = 30 г/моль
Определяем молярную массу соединения:
М = Vm · m/ V = (22,4 · 2,41)/0,3 = 180 г/моль
К = 180 : 30 = 6
Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6.
Ответ: искомая формула - C6H12О6
Задача 2. Какова молекулярная формула органического соединения, имеющего относительную плотность паров по воздуху 1,517, если при сгорании 4,4 г его в кислороде образовалось 13,2 г СО2 и 7,2 г Н2О.
Решение:
1. Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности:
Мr (CхHу) = Dвоздуху * Mr (воздуха) = 1,517 * 29 = 44
2. Составляем пропорции:
44/13,2 = 12/ х
х = 13,2 * 12/44 = 3,6 г
18/7,2 = 2/y
у = 7,2 * 2/18 = 0,8 г
m (О) = 4,4 – 3,6 – 0,8 = 0
Следовательно это углеводород:
х : у = 3,6/12 : 0,8/1 = 0,3 : 0,8 = 3 : 8
Формула соединения C3H8;
Мr (C3H8) = 44
Ответ: молекулярная формула соединения C3H8
Задача 3. Установите формулу предельной одноосновной карбоновой кислоты, массовая доля углерода в которой 54,55%.
Решение:
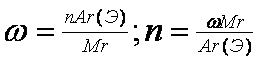
Исходя из того, что общая формула предельной одноосновной карбоновой кислоты СnН2nО2, запишем выражение для относительной молекулярной массы:
12n + 2n + 32 = 14n + 32
Подставляем известные значения в формулу:
О,5455 = 12n / 14n + 32
7,64n + 17,5 = 12n
4,36n = 17,5
n = 4
Ответ: C3H7COOH
Задача 4. Определите молекулярную формулу карбоновой кислоты, в которой массовая доля кислорода в 1,333 раза больше массовой доли углерода.
Решение:
ω(О) = 1,333 ω(С)
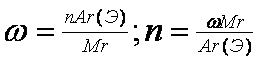
Так как знаменатель при расчёте массовых долей одна и та же величина, то
n (O) * Ar (O) = 1,333 n (C) * Ar (C)
2*16 = 1,333 * 12 n (C)
32 = 16 n (C)
n (C) = 2 , следовательно, формула кислоты CH3COOH.
Ответ: CH3COOH
Задача 5. Химический элемент А образует два оксида с массовой долей элемента 0,5 и 0,4 соответственно. Определите элемент А и формулы оксидов.
Решение:
В решении задачи применим закон эквивалентов
Как известно, оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления – 2
Кислород в оксидах двухвалентен, его Аr(О) = 16,
а Э(О) = 16 / 2 = 8.
Из закона эквивалентов следует, что химические элементы соединяются друг с другом в молекулы в строго определённом соотношении:
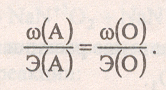
Сделаем расчёт для первого оксида:
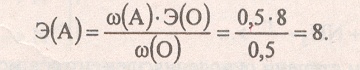
Это может быть четырёхвалентная сера (Аr = 8 * 4 = 32), а её оксид — SO2.
Сделаем расчёт для второго оксида:
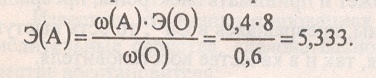
Это соответствует шестивалентной сере (Аr = 5,333 * 6 = 32), и
её оксид — SO3.
Таким образом, химический элемент — сера S.
Ответ: сера, SO2 , SO3.
Тема 8.
Определение состава смесей
Задача 1. В каком объемном соотношении необходимо смешать водород и углекислый газ, чтобы получить газовую смесь по плотности равную воздуху.
Решение:
Квадрат Пирса (правило «креста»). Как известно (закон Авогадро), равные количества газов занимают равные объемы. Следовательно, если молярные массы газов равны, значит, равны и их плотности. Поэтому, нужно смешать водород и углекислый газ так, чтобы средняя молярная масса полученной газовой смеси была равна молярной массе воздуха (29 г/моль). Определив молярные массы H2 и СO2 , зная среднюю молярную массу воздуха, расставим их в виде треугольника:
H 2 2
2 2
В оздух 29
оздух 29
СO2 44
Найдем разницу в числах по диагонали 29 – 2 = 27; 44 – 29 = 15. Проставим их, в соответствии с диагональю, по которой они были определены 27 – напротив CO2; 15 – напротив H2:
H
 2 2 15
2 2 15
В оздух 29
оздух 29

СO2 44 27
Отношение 15 : 27 и будет ответом.
Ответ: Водород и углекислый газ и необходимо смешать в объемном соотношении 15 : 27.
Задача 2. Природный хлор представлен двумя изотопами 35Сl и 37Сl. Во сколько раз ядер 35Сl больше, чем ядер 37Сl?
Решение:
Воспользуемся для решения правилом «креста»
3
 5Сl 35 1,5
5Сl 35 1,5
3
 5,5
5,5
37Сl 37 0,5
Полученное соотношение 1,5 : 0,5 свидетельствует, что атомов хлора с массовым числом 35 в три раза больше.
Ответ: в 3 раза.
Задача 3. Газовая смесь содержит этан, этилен и ацетилен. Как доказать присутствие в данной смеси каждого из газов? Напишите уравнения необходимых реакций.
Решение:
При пропускании смеси через аммиачный раствор оксида серебра поглощается только ацетилен:
С2Н2 + Аg2O = С2Аg2 + НОН.
Из оставшихся газов бромную воду будет обесцвечивать только этилен:
С2Н4 + Вr2 = С2Н4Вr2.
Третий газ (этан) горит:
2С2Н6 + 7О2 = 4СО2 + 6Н2О.
Задача 4. Выделите в чистом виде компоненты смеси, состоящей из ацетилена, пропена и пропана. Напишите уравнения необходимых реакций.
Решение:
При пропускании смеси через аммиачный раствор оксида серебра поглощается только ацетилен:
С2Н2 + Аg2O = С2Аg2 + НОН.
Для регенерации ацетилена полученный ацетиленид серебра обрабатывают соляной кислотой:
С2Аg2 + 2НСl = С2Н2 + 2AgCl.
При пропускании оставшихся газов через бромную воду поглотится пропен:
С3Н6 + Br2 = С3H6Br2.
Для регенерации пропена полученный дибромпропан обрабатывают цинковой пылью:
С3H6Br2 + Zn = С3Н6+ ZnBr2.
Тема 9.
Качественные задачи
Пример практической работы
Распознавание веществ
Оборудование и реактивы: четыре пронумерованные пробирки, в которых содержатся: карбоната натрия, хлорида бария, растворов соляной и серной кислот и неограниченное число чистых пробирок.
Ход работы.
Составим таблицу:
|
| Na2CO3 | BaCl2 | HCl | H2SO4 |
| Na2CO3
| ////////// | B aCO3 aCO3 | C O2 O2 | C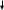 O2 O2 |
| BaCl2
| B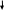 aCO3 aCO3 | ////////// | _ | B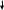 aSO4 aSO4 |
| HCl
| C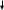 O2 O2 | _ | ////////// | _ |
| H2SO4
| C O2 O2 | B aSO4 aSO4 | _ | ////////// |
Na2CO3 + 2HCl = CO2 + 2NaCl + Н2О
Na2CO3 + H2SO4 = CO2 + Na2SO4 + Н2О
BaCl2 + H2SO4 = BaSO4 + 2HCl
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Из данных таблицы делаем такие выводы:
Вещество, которое при прибавлении к другим растворам вызывало выпадение осадка и дважды выделение газа, - это карбонат натрия.
Веществом, вызывающим выпадение осадка в двух случаях, является хлорид бария.
В случае одноразового выделения газа использовали раствор соляной кислоты.
А там, где один раз выделился газ и один раз выпал осадок, применяли раствор серной кислоты.
РЕЦЕНЗИЯ






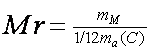
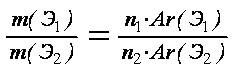
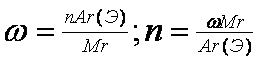
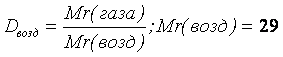
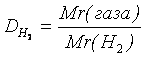
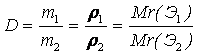
 6 %
6 %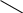 0 %
0 %

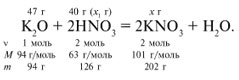 r (KNO3) = 39 + 14 + 3*16 = 101.
r (KNO3) = 39 + 14 + 3*16 = 101.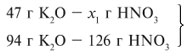
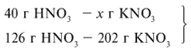 ледовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ледовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3: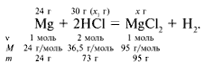 r(MgCl2) = 24 + 2•35,5 = 95.
r(MgCl2) = 24 + 2•35,5 = 95.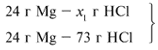 ля удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
ля удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.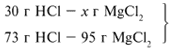 з расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:
з расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте: ,64 = 1,8
,64 = 1,8 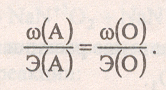
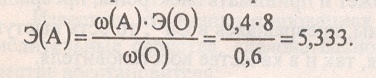
 2 2
2 2 оздух 29
оздух 29 aCO3
aCO3 O2
O2 aSO4
aSO4









