МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 36» Г. БЕЛГОРОДА
| «РАССМОТРЕНО» Руководитель ШМО
_________/Е.Н. Мальцева Протокол № ______ от «___»_______2019г. | «СОГЛАСОВАНО» Заместитель директора МБОУ «Средняя общеобразовательная школа № 36» г. Белгорода
________ / Л. М. Усачева
«___»__________2019 г.
| «УТВЕРЖДАЮ» Директор МБОУ «Средняя общеобразовательная школа № 36» г. Белгорода _________О. В. Тучкова
Приказ №____ от «___»________2019 г.
|
РАБОЧАЯ ПРОГРАММА
ПО ХИМИИ
для 9 «А», 9 «Б», 9 «В» классов
(базовый уровень)
Разработала:
учитель химии
Кадышева Валерия Александровна
2019 г.
1. Пояснительная записка
Рабочая программа по химии для 9 «А, Б, В» классов базового уровня разработана на основе рабочей программы по химии для 9х классов базового уровня основного образования, утвержденной приказом по школе от 30.08.2018 года №1126 «Об утверждении рабочих программ по предметам на уровне начального общего, основного общего и среднего общего образования». Рабочая программа по химии составлена в соответствии с федеральным государственным образовательным стандартом основного общего образования утвержденного приказом Минобрнауки РФ от 17.12.2010 г. № 1897. За основу рабочей программы взята рабочая программа по химии для 8-9 классов общеобразовательных учреждений к УМК Г.Е. Рудзитис, Ф.Г. Фельдман., составленная на основе Федерального государственного образовательного стандарта основного общего образования, опубликованная издательством «Просвещение» в 2013 году.
Гара Н.Н. Химия Рабочие программы. Предметная линия учебников Рудзитис, Ф.Г. Фельдман. 8-9 классы/ Н.Н. Гара.- М.: Просвещение, 2013. – 48
Рудзитис Г.Е. Химия 9 кл: учеб.: для общеобразовательных организаций/Г.Е. Рудзитис, Ф.Г. Фельдман. – 6-е изд. - М.: Просвещение, 2019. -208с.
Авторская программа Н.Н. Гара рассчитана на 68 часов, рабочая программа составлена на 68 часов (в соответствии с Базисным учебным планом), исходя из расчета - 34 учебные недели, 2 часа в неделю, в том числе отводится на контрольные работы – 4 часа, практические работы – 7 часов.
2. Календарно-тематическое планирование.
| № Урока
| Дата проведения 9 «А, Б, В» | Тема урока | Виды деятельности (элементы содержания, контроль) |
| По плану | По факту |
| Раздел 1. Многообразие химических реакций (15 час). |
| Тема 1. Классификация химических реакций (6 час). |
| 03.09.19 |
| Вводный инструктаж по Т.Б. Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления. | Отличать окислительно-восстановительные реакции от химических реакций других типов. Уравнивать окислительно-восстановительные реакции. |
| 04.09.19 |
| Окислительно-восстановительные реакции. | Отличать окислительно-восстановительные реакции от химических реакций других типов. Уравнивать окислительно-восстановительные реакции. |
| 10.09.19 |
| Тепловые эффекты химических реакций. Экзо- и эндотермические реакции | Отличать термохимические уравнения реакций от других видов уравнений химических реакций. Различать экзо- и эндотермические реакции. |
| 11.09.19 |
| Скорость химических реакций. Первоначальные представления о катализе | Наблюдать и описывать химические реакции, сравнивать, сопоставлять, делать выводы. |
| 17.09.19 |
| Инструктаж по Т.Б. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость | Пользоваться лабораторным оборудованием, нагревательными приборами, оказывать первую помощь при ожогах и травмах, полученных во время работы с реактивами и лабораторным оборудование, исследовать условия, влияющие на скорость химической реакции. |
| 18.09.19 |
| Обратимые и необратимые реакции. Понятие о химическом равновесии | Наблюдать и описывать химические реакции, сравнивать, сопоставлять, делать выводы. |
| Тема 2. Химические реакции в водных растворах (9 час). |
| 24.09.19 |
| Сущность процесса электролитической диссоциации | Использовать межпредметные связи, проводить наблюдения по ходу демонстрационного эксперимента, исследовать свойства растворов электролитов и неэлектролитов, обсуждать в группах результаты опытов.
|
| 25.09.19 |
| Диссоциация кислот, оснований и солей | Проводить наблюдения в ходе демонстрационного эксперимента, исследовать свойства растворов электролитов, обсуждать результаты опытов, делать выводы. |
| 01.10.19 |
| Сильные и слабые электролиты. Степень диссоциации | Работать с текстом, находить в нём ответы на заданные учителем вопросы, проводить наблюдения за ходом демонстрационного эксперимента, обсуждать результаты опытов, делать выводы. |
| 02.10.19 |
| Реакции ионного обмена и условия их протекания | Наблюдать и описывать свойства изучаемых веществ в ходе лабораторного эксперимента. Использовать лабораторное оборудование и химическую посуду. |
| 08.10.19 |
| Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях. Инструктаж по Т.Б. Лабораторный опыт 1. Качественные реакции на катионы и анионы. | Исследовать свойства растворов электролитов, описывать свойства изучаемых веществ в ходе лабораторного эксперимента, давать определения понятий «электролит», неэлектролит», «ион», «катион», «анион». Составлять полные и сокращённые ионные уравнения реакций на примере свойств основных классов неорганических соединений. |
| 09.10.19 |
| Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | Давать определения понятий «электролит», «неэлектролит», «ион», «катион», «анион». Составлять полные и сокращённые ионные уравнения реакций на примере свойств основных классов неорганических соединений. |
| 15.10.19 |
| Гидролиз солей. Обобщение по темам «Классификация химических реакций» и «Электролитическая диссоциация» | Наблюдать и описывать свойства изучаемых веществ в ходе лабораторного эксперимента. Использовать лабораторное оборудование и химическую посуду.
|
| 16.10.19 |
| Инструктаж по Т.Б. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов» | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами, оказывать первую помощь при ожогах и травмах, полученных при работе с реактивами и лабораторным оборудованием, исследовать свойства растворов электролитов. |
| 22.10.19 |
| Контрольная работа № 1 по темам «Классификация химических реакций» и «Электролитическая диссоциация» | Выполнять задания определённой сложности по пройденному материалу. |
| Раздел 2. Многообразие веществ (43 час). |
| Тема 3. Галогены (5 час). |
| 23.10.19 |
| Анализ контрольной работы. Положение галогенов в периодической таблице и строение их атомов. Получение галогенов. Физические и химические свойства галогенов. Инструктаж по Т.Б. Л. о. 2. Вытеснение галогенами друг друга из растворов их соединений. | Самостоятельная работа с книгой с целью углубления знаний о периодическом законе и периодической системе химических элементов Д. И. Менделеева и строении вещества. |
| 06.11.19 |
| Хлор. Свойства и применение хлора | Работать с текстом, находить примеры, подтверждающие текстовую информацию, наблюдать за ходом эксперимента и обсуждать его. Записывать уравнения реакций и объяснять их с точки зрения окисления и восстановления. |
| 12.11.19 |
| Хлороводород: получение и физические свойства | Соблюдать правила техники безопасности при работе с концентрированными кислотами, нагревательными приборами. Наблюдать демонстрационные и самостоятельные опыты. Описывать свойства изучаемого вещества на основе наблюдений. |
| 13.11.19 |
| Соляная кислота и её соли | Самостоятельно работать с целью углубления знаний о получении и свойствах хлороводорода, о составе, свойствах и применении соляной кислоты. Соблюдать меры предосторожности при работе с химическими реактивами. |
| 19.11.19 |
| Инструктаж по Т.Б. Практическая работа 3. Получение соляной кислоты и изучение её свойств. | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами, оказывать первую помощь при ожогах и травмах, полученных при работе с реактивами и лабораторным оборудованием, исследовать свойства изучаемых веществ. |
| Тема 4. Кислород и сера (8 час). |
| 20.11.19 |
| Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Аллотропия серы. Инструктаж по Т.Б. Лабораторный опыт 3. Ознакомление с образцами серы и ее природных соединений. | Самостоятельно работать с учебником с целью углубления знаний о периодическом законе и периодической системе химических элементов Д. И. Менделеева, строении вещества. |
| 26.11.19 |
| Свойства и применение серы | Самостоятельно составлять уравнения реакций, подтверждающих окислительные и восстановительные свойства серы, сравнивать свойства простых веществ серы и кислорода, разъяснять эти свойства в свете представлений об окислительно-восстановительных процессах. |
| 27.11.19 |
| Сероводород. Сульфиды. Инструктаж по Т.Б. Лабораторный опыт 4. Распознавание сульфид-ионов в растворе. | Самостоятельно составлять уравнения реакций, подтверждающих свойства сероводорода, молекулярные формулы средних и кислых солей. Проводить химический эксперимент по распознаванию сульфид-ионов. |
| 03.12.19 |
| Оксид серы(IV). Сернистая кислота и её соли. Инструктаж по Т.Б. Лабораторный опыт 5. Распознавание сульфит-ионов в растворе. | Самостоятельно составлять уравнения реакций, подтверждающих свойства сернистого газа и сернистой кислоты, молекулярные формулы средних и кислых солей. Проводить химический эксперимент по распознаванию сульфит-ионов. |
| 04.12.19 |
| Оксид серы(VI). Серная кислота и её соли. Инструктаж по Т.Б. Лабораторный опыт 6. Распознавание сульфат-ионов в растворе. | Самостоятельно составлять уравнения реакций, подтверждающих свойства разбавленной серной кислоты, и разъяснять их в свете представлений об электролитической диссоциации и окислительно-восстановительных процессах. Составлять молекулярные формулы средних и кислых солей серной кислоты. Проводить химический эксперимент по распознаванию сульфат-ионов. |
| 10.12.19 |
| Окислительные свойства концентрированной серной кислоты | Составлять уравнения реакций, подтверждающих свойства концентрированной серной кислоты, и разъяснять их в свете представлений об окислительно-восстановительных процессах. |
| 11.12.19 |
| Инструктаж по Т.Б. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера» | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами, оказывать первую помощь при ожогах и травмах, полученных при работе с реактивами и лабораторным оборудованием, исследовать свойства изучаемых веществ. |
| 17.12.19 |
| Решение расчётных задач | Научить решать задачи по уравнениям химических реакций с использованием веществ, содержащих определённую долю примесей |
| Тема 5. Азот и фосфор (9 час). |
| 18.12.19 |
| Положение азота и фосфора в периодической таблице химических элементов, строение их атомов. Азот: свойства и применение | Самостоятельно давать характеристику элементов VA-группы на основании их положения в периодической системе и строения атомов. Рассматривать химические свойства азота с точки зрения представлений об окислительно-восстановительных процессах. Обсуждать роль азота в природе. |
| 24.12.19 |
| Аммиак: физические и химические свойства, получение и применение | Составлять схему образования иона аммония. Характеризовать физические свойства аммиака на основе наблюдения демонстрационного опыта получения аммиака. Объяснять реакции горения аммиака в кислороде и окисления кислородом в присутствии катализатора с точки зрения представлений об окислительно-восстановительных процессах. Самостоятельно работать с учебником. |
| 25.12.19 |
| Инструктаж по Т.Б. Практическая работа 5. Получение аммиака и изучение его свойств. | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами, оказывать первую помощь при ожогах и травмах, полученных при работе с реактивами и лабораторным оборудованием, исследовать свойства аммиака. |
| 14.01.20 |
| Соли аммония. Инструктаж по Т.Б. Лабораторный опыт 7. Взаимодействие солей аммония со щелочами. | Составлять уравнения химических реакций, характеризующих химические свойства солей аммония, и разъяснять их в свете представлений об электролитической диссоциации. Проводить химический эксперимент. |
| 15.01.20 |
| Азотная кислота: строение молекулы, получение. Общие свойства азотной кислоты | Изображать структурную формулу азотной кислоты, определять валентность и степень окисления атома азота в молекуле азотной кислоты. Обсуждать общие свойства кислот на примере свойств разбавленной азотной кислоты. Оценивать правильность выполнения учебной задачи. Рассматривать химические реакции промышленного получения азотной кислоты с точки зрения окислительно-восстановительных процессов. |
| 21.01.20 |
| Окислительные свойства азотной кислоты | Сопоставлять свойства разбавленной и концентрированной азотной кисло- ты. Характеризовать свойства веществ в ходе демонстрационного эксперимента. Использовать метод электронного баланса при расстановке коэффициентов в уравнениях окислительно- восстановительных реакций. |
| 22.01.20 |
| Соли азотной кислоты. Азотные удобрения | Составлять уравнения реакций разложения нитратов. Объяснять качественную реакцию на нитрат-ионы, отличать соли азотной кислоты от хлоридов, сульфатов, сульфидов и сульфитов, объяснять круговорот азота в природе. |
| 28.01.20 |
| Фосфор: аллотропия и свойства | Характеризовать фосфор на основании его положения в периодической системе Д. И. Менделеева. Изучать свойства белого и красного фосфора. Составлять уравнения химических реакций, характеризующих свойства фосфора как окислителя и как восстановителя, и объяснять их с точки зрения окислительно- восстановительных процессов. |
| 29.01.20 |
| Оксид фосфора(V). Фосфорная кислота и её соли. Фосфорные удобрения | Записывать уравнения реакций, характеризующих свойства оксида фосфора(V) как кислотного оксида. Работать в парах. |
| Тема 6. Углерод и кремний (8 час). |
| 04.02.20 |
| Положение углерода и кремния в периодической таблице химических элементов, строение их атомов. Аллотропные модификации углерода | Самостоятельно характеризовать элементы IVA-группы на основании положения их в периодической системе и строения их атомов. |
| 05.02.20 |
| Химические свойства углерода. Адсорбция | Объяснять явление адсорбции на основе демонстрационного эксперимента. Составлять уравнения химических реакций, характеризующих свойства углерода как окислителя и как восстановителя, и объяснять их с точки зрения окислительно-восстановительных процессов. |
| 11.02.20 |
| Угарный газ: свойства и физиологическое действие. Углекислый газ. Инструктаж по Т.Б. Лабораторный опыт 8. Качественная реакция на углекислый газ. | Самостоятельно работать с учебником. Работать в парах. Доказывать кислотный характер оксида углерода(IV), проводить качественную реакцию на оксид углерода(IV), соблюдать правила техники безопасности при проведении лабораторного опыта. |
| 12.02.20 |
| Угольная кислота и её соли. Инструктаж по Т.Б. Лабораторный опыт 9. Качественная реакция на карбонат-ионы. | Участвовать во фронтальной беседе. Проводить качественную реакцию на карбонат-ионы. Соблюдать правила безопасности при работе с кислотами. Характеризовать свойства веществ в ходе лабораторного эксперимента. |
| 18.02.20 |
| Инструктаж по Т.Б. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и реактивами, оказывать первую помощь при ожогах и травмах, связанных с реактивами и лабораторным оборудованием, исследовать свойства изучаемых веществ. |
| 19.02.20 |
| Кремний. Оксид кремния(IV). Кремниевая кислота и её соли. Стекло. Цемент | Характеризовать свойства кремниевой кислоты и её солей. Самостоятельно составлять уравнения химических реакций, характеризующих свойства кремниевой кислоты и её солей, и объяснять эти реакции с точки зрения электролитической диссоциации. |
| 25.02.20 |
| Обобщение по теме «Неметаллы» | Работать индивидуально и в группах. |
| 26.02.20 |
| Контрольная работа по теме №2 «Неметаллы» | Самостоятельно выполнять задания определённой сложности по пройденному материалу. |
| Тема 7. Общие свойства металлов (13 час). |
| 03.03.20 |
| Анализ контрольной работы. Положение металлов в периодической таблице химических элементов. Металлическая связь. Физические свойства металлов. Сплавы металлов. Инструктаж по Т.Б. Лабораторный опыт 10. Рассмотрение образцов металлов. | Характеризовать металлы на основании их положения в периодической системе и строения их атомов. Объяснять закономерности изменения свойств металлов по периоду и в А-группах. Использовать приобретённые знания о металлической связи для разъяснения физических свойств металлов. Сравнивать металлы и сплавы. |
| 04.03.20 |
| Нахождение металлов в природе и общие способы их получения. | Отрабатывать навыки составления уравнений окислительно-восстановительных реакций. Решать расчётные задачи. |
| 10.03.20 |
| Химические свойства металлов. Электрохимический ряд напряжений Металлов. Инструктаж по Т.Б. Лабораторный опыт 11. Взаимодействие металлов с растворами солей. | Записывать уравнения реакций, характеризующих химические свойства металлов с точки зрения окислительно-восстановительных процессов. Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами. |
| 11.03.20 |
| Щелочные металлы: нахождение в природе, свойства. | Характеризовать положение щелочных металлов в периодической таблице и строение их атомов. Отрабатывать умение записывать уравнения реакций, характеризующих химические свойства щелочных металлов. |
| 17.03.20 |
| Оксиды и гидроксиды щелочных металлов. Применение щелочных металлов. | Отрабатывать умение составлять уравнения реакций, характеризующих химические свойства оксидов и гидроксидов щелочных металлов с точки зрения окислительно-восстановительных процессов и электролитической диссоциации. |
| 18.03.20 |
| Магний. Щелочноземельные металлы. Кальций и его соединения. Жёсткость воды и способы её устранения. Инструктаж по Т.Б. Лабораторный опыт 12. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. | Отработка умений записывать уравнения реакций, характеризующих химические свойства щелочноземельных металлов с точки зрения окислительно-восстановительных процессов и электролитической диссоциации. |
| 01.04.20 |
| Алюминий:физические и химические свойства | Отрабатывать навыки составления уравнений окислительно-восстановительных реакций. Обсуждать демонстрационный эксперимент. Описывать свойства изучаемых веществ. |
| 07.04.20 |
| Амфотерность оксида и гидроксида алюминия. Инструктаж по Т.Б. Лабораторные опыты 13. Получение гидроксида алюминия реакцией обмена. Взаимодействие гидроксида алюминия с кислотой и щёлочью. | Отрабатывать навыки проведения химического эксперимента. Соблюдать правила техники безопасности. Практически доказывать амфотерный характер оксидов и гидроксидов алюминия. Описывать изучаемые вещества в ходе проведения химического эксперимента. |
| 08.04.20 |
| Железо:нахождение в природе и свойства | Отрабатывать умение составлять уравнения реакций, характеризующих химические свойства железа с точки зрения окислительно-восстановительных процессов. Самостоятельно работать с учебником. |
| 14.04.20 |
| Оксиды, гидроксиды и соли железа(II) и железа(III). Инструктаж по Т.Б. Лабораторный опыт 14. Качественные реакции на ионы Fe2+ и Fe3+ . | Отрабатывать экспериментальные умения, соблюдать правила техники безопасности. Отрабатывать умение записывать уравнения реакций, характеризующих химические свойства соединений железа с точки зрения окислительно-восстановительных процессов и электролитической диссоциации. |
| 15.04.20 |
| Инструктаж по Т.Б. Практическая работа 7. Решение экспериментальных задач по теме «Металлы» | Соблюдать правила техники безопасности при работе с лабораторным оборудованием и химическими реактивами, оказывать первую помощь при ожогах и травмах, полученных при работе с реактивами и лабораторным оборудованием, исследовать свойства изучаемых веществ. |
| 21.04.20 |
| Обобщение по теме «Металлы и их соединения» | Работать индивидуально и в группах. |
| 22.04.20 |
| Контрольная работа №3 по теме «Металлы и их соединения» | Самостоятельно выполнять задания определённой сложности по пройден- ному материалу. |
| Раздел 3. Краткий обзор важнейших органических соединений (10 час). |
| Тема 8. Первоначальные представления об органических веществах (10 час). |
| 28.04.20 |
| Анализ контрольной работы. Органическая химия. Предельные (насыщенные) углеводороды . | Составлять конспект лекции. Вырабатывать умение составлять структурные формулы органических веществ. Отрабатывать умения составлять структурные формулы алканов, определять гомологи углеводородов. |
| 29.04.20 |
| Непредельные (ненасыщенные) углеводороды | Составлять конспект лекции. Отрабатывать умения составлять структурные формулы органических веществ, записывать уравнения реакций, характеризующих свойства непредельных углеводородов. |
| 05.05.20 |
| Полимеры. | Составлять конспект лекции.
|
| 06.05.20 |
| Производные углеводородов. Спирты | Составлять конспект изучаемого параграфа. Готовить электронные презентации по теме урока. |
| 12.05.20 |
| Карбоновые кислоты. Сложные эфиры. Жиры | Составлять конспект урока. Использовать ранее полученные знания при изучении нового материала. |
| 13.05.20 |
| Углеводы. Аминокислоты. Белки Обобщающий урок по теме «Важнейшие органические соединения» | Составлять конспект изучаемого параграфа. Готовить электронные презентации по теме урока. |
| 19.05.20 |
| Контрольная работа №4 по теме «Органические соединения» | Самостоятельно выполнять задания определённой сложности по пройденному материалу. |
| 20.05.20 |
| Анализ контрольной работы. Повторение по курсу химии 9 класса | Работать самостоятельно и в группах. |
| 20.05.20 |
| Повторение по курсу химии 9 класса | Работать самостоятельно и в группах. |
| 20.05.20 |
| Повторение по курсу химии 9 класса | Работать самостоятельно и в группах. |
3. Перечень оборудования
| Темы практических работ и лабораторных опытов | Оборудование и реактивы
|
| Практические работы |
| Практическая работа №1 «Изучение влияния условий проведения химической реакции на её скорость» | Инструкция по технике безопасности, пробирки, Mg, Zn, Cu, HCl, CaCO3, H2O2, MnO2, лучинка. |
| Практическая работа №2 «Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»» | Пробирки, H2SO4, Zn, HCl, Mg, NaOH, Na2CO3, Zn(NO3)2. |
| Практическая работа №3 «Получение соляной кислоты и изучение её свойств.» | Штатив, спиртовка, спички, серная кислота, вата, пробирки, поваренная соль, лакмусовая бумага, цинк, медь, оксид меди (ll),гидроксид меди (ll), нитрат серебра. |
| Практическая работа №4 «Решение экспериментальных задач по теме «Кислород и сера»» | Штатив с пробирками, хлорид бария, карбонат натрия, серная кислота, гидроксид натрия, соляная кислота, хлорид железа (III), хлорид алюминия, пробирки под номерами (серная кислота, сульфат натрия, карбонат натрия), лакмус, лоточек. |
| Практическая работа №5 «Получение аммиака и изучение его свойств.» | Хлорид аммония, гидроксид кальция, фарфоровая ступка с пестиком, пробирки, штатив, спиртовка, спички, вата, сосуд с водой, лакмусовая бумага, фенолфталеин, азотная, соляная, серная к-ты. |
| Практическая работа №6 «Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов» | Штатив с пробирками, мел или мрамор, соляная кислота, известковая вода, лакмус. |
| Практическая работа 7. Решение экспериментальных задач по теме «Металлы» | Инструкция по технике безопасности, осуществить предложенные химические превращения.
|
| Лабораторные опыты
|
| Лабораторный опыт 1. Качественные реакции на катионы и анионы. | Штатив с пробирками, хлорид натрия, нитрат серебра, карбонат натрия, соляная кислота, азотная кислота, гидроксид калия. Хлорид магния, сульфат натрия. |
| Лабораторный опыт 2. Вытеснение галогенами друг друга из растворов их соединений. | Штатив с пробирками, бромид калия, иодид калия, хлорная и бромная вода. |
| Лабораторный опыт 3. Ознакомление с образцами серы и ее природных соединений. | Коллекция серы. |
| Лабораторный опыт 4. Распознавание сульфид-ионов в растворе. | Штатив с пробирками, сульфид натрия, нитрат меди. |
| Лабораторный опыт 5. Распознавание сульфит-ионов в растворе. | Штатив с пробирками, сульфит натрия, серная кислота. |
| Лабораторный опыт 6. Распознавание сульфат-ионов в растворе. | Штатив с пробирками, раствор хлорида бария, раствор сульфита натрия, раствор сульфата натрия, раствор азотной кислоты |
| Лабораторный опыт 7. Взаимодействие солей аммония со щелочами. | Штатив с пробирками, спиртовка, пробиркодержатель, раствор хлорида аммония, лакмусовая бумага, вода |
| Лабораторный опыт 8. Качественная реакция на углекислый газ. | Штатив с пробирками, штатив лабораторный, прибор для получения углекислого газа, мел (мрамор), соляная кислота, известковая вода. |
| Лабораторный опыт 9. Качественная реакция на карбонат-ионы. | Штатив с пробирками, крист. Карбонат калия, раствор карбоната натрия, раствор соляной кислоты. |
| Лабораторный опыт 10. Рассмотрение образцов металлов. | Коллекция металлов. |
| Лабораторный опыт 11. Взаимодействие металлов с растворами солей. | Штатив с пробирками , железо или железный гвоздь, очищенный наждачной бумагой, медный купорос, соляная кислота, цинк. |
| Лабораторный опыт 12. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. | Штатив с пробирками, гидроксид кальция, оксид углерода (V).
|
| Лабораторный опыт 13. Получение гидроксида алюминия реакцией обмена. Взаимодействие гидроксида алюминия с кислотой и щёлочью. | Штатив с пробирками, гидроксид натрия, хлорид алюминия, соляная кислота, гидроксид натрия. |
| Лабораторный опыт 14. Качественные реакции на ионы Fe2+ и Fe3+ . | Штатив с пробирками , свежеприготовленный раствор сульфата железа (ΙΙ), раствор гидроксида натрия, раствор гексацианоферрата(ΙΙΙ), калия (красная кровяная соль). Раствор хлорида железа(Ш), раствор гидроксида натрия, раствор гексацианоферрата(ΙΙ) калия K4[Fе(CN)6] (жёлтой кровяной соли), вода, раствор роданида калия |
В соответствии с методическими рекомендациями инструктивно - методического письма ОГАОУ ДПО БелИРО «О преподавании предмета «Химия» в образовательных организациях Белгородской области в 2018-2019 учебном году» рабочей программой предусматривается проведение 4 контрольных работ:
Контрольная работа №1 по темам: «Классификация химических реакций» и «Электролитическая диссоциация»».
Контрольная работа №2 по теме: «Неметаллы».
Контрольная работа №3 по теме: «Металлы и их соединения»
Контрольная работа № 4 по теме: «Органические соединения»
Кроме выше перечисленных основных форм контроля будут осуществляться небольшие текущие самостоятельные тестовые работы (в форме ОГЭ) в рамках каждой темы в виде фрагментов урока.
Контрольная работа №1 по темам: «Классификация химических реакций» и «Электролитическая диссоциация»».
Вариант I
1. Объясните на основе знаний об электролитической диссоциации, почему растворы кислот имеют общие свойства.
2. Допишите уравнения практически осуществимых химических реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации.
 Zn + H2SO4
Zn + H2SO4
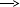 Cu + HCl
Cu + HCl
 Na2SO4 + BaCl2
Na2SO4 + BaCl2
3. Даны вещества: хлорид железа(III), бромид натрия, бромоводород, карбонат кальция, оксид серы(VI). К каждому из них добавили гидроксид натрия. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме.
4. Приведите два примера реакций ионного обмена, суть которых может быть выражена одним и тем же сокращённым ионным уравнением реакции
 Pb2+ + 2OH-= Pb(OH)2
Pb2+ + 2OH-= Pb(OH)2
5. Приведите два примера реакций соединения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится.
6. Составьте термохимическое уравнение реакции горения метана в кислороде, если при сжигании 21 л метана (н. у.) выделилось 837 кДж теплоты.
Вариант II
1. Объясните на основе знаний об электролитической диссоциации, почему растворы щелочей имеют общие свойства.
2. Допишите уравнения практически осуществимых химических реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации.
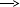 K2CO3 + HNO3
K2CO3 + HNO3
 Mg + FeSO4
Mg + FeSO4
 Na2CO3 + Cu
Na2CO3 + Cu
3. Даны вещества: сульфат натрия, оксид меди(II), карбонат калия, гидроксид калия. К каждому из них добавили разбавленную серную кислоту. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме.
4. Приведите два примера реакций ионного обмена, суть которых может быть выражена одним и тем же сокращённым ионным уравнением реакции
 CO2-3 + 2H+ = H2O +CO2
CO2-3 + 2H+ = H2O +CO2
5. Приведите два примера реакций разложения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится.
6. Используя термохимическое уравнение
CaCO3(тв) + CO2(г) – 177,65 кДж,
рассчитайте количество теплоты, которая потребуется для разложения 50 кг карбоната кальция.
Контрольная работа №2 по теме: «Неметаллы».
Вариант I
1. Схема строения атома химического элемента кремния
1) +32 ) ) ) )
2 8184
2) +20 ) ) ) )
2 8 8 2
3) +16 ) ) )
2 8 6
4) +14 ) ) )
2 8 4
2. Положительную степень окисления хлор проявляет в соединении
1) NaCl 2) PCl5 3) HCl 4) Cl2O7
3. Кислотные свойства высших оксидов химических элементов VА-группы периодической таблицы Д. И. Менделеева в ряду


 N2O5 P2O5 As2O5 Sb2O5
N2O5 P2O5 As2O5 Sb2O5
1) усиливаются
2) ослабевают
3) остаются неизменными
4) сначала усиливаются, затем ослабевают
4. Аммиак не вступает в химическую реакцию
1) с кислородом 3) с соляной кислотой
2) с водородом 4) с водой
5. Соединения серы с металлами называют
1) сульфатами 3) сульфидами
2) сульфитами 4) сернистыми металлами
6. В результате окисления аммиака в присутствии катализатора образуются
1) оксид азота(II) и вода 3) азот и вода
2) оксид азота(IV) и вода 4) оксид азота(II) и водород
А-7. Сокращённому ионному уравнению
CO2 + 2OH- = H2O + CO32-
соответствует химическая реакция
1) между соляной кислотой и карбонатом кальция
2) между гидроксидом натрия и оксидом углерода(IV)
3) между кремниевой кислотой и карбонатом калия
4) между карбонатом натрия и оксидом кремния(IV)
8. Реакцией ионного обмена не является реакция
1) NaBr + AgNO3 = NaNO3 + AgBr
2) (NH4)2CO3 = 2NH3 + CO2 + H2O
3) NH4OH + HNO3 = NH4NO3 + H2O
4) 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2
9. Установите соответствие между исходными (исходным) и полученными веществами в уравнениях химических реакций, характеризующих свойства фосфорной кислоты.
|  1) H3PO4 + Ca 1) H3PO4 + Ca
| A. P2O5 + H2O |
| 2) H3PO4 + Ca(OH)2 | Б. Ca3(PO4)2 + HCl |
|  3) H3PO4 + CaCl2 3) H3PO4 + CaCl2
| В. P + H2O |
|  4) H3PO4 4) H3PO4
| Г. Ca3(PO4)2 + H2 |
|
| Д. Ca3(PO4)2 + H2O |
10. Установите соответствие между реактивом и группой веществ, которые можно обнаружить с помощью этого реактива.
| 1) растворимые соли бария | А. карбонаты |
| 2) растворимые соли серебра | Б. сероводородная кислота и растворимые в воде сульфиды |
| 3) летучие кислоты (соляная, азотная, уксусная) | В. галогеноводородные кислоты и их соли, кроме фтористоводородной кислоты |
| 4) растворимые соли меди | Г. соли железа в степенях окисления +2 и +3 или соли свинца |
|
| Д. серная кислота и её соли — сульфаты. |
11. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим её.
|  1) N0 N+2 1) N0 N+2
|  А. HNO3 + Cu Cu(NO3)2 + NO + H2O А. HNO3 + Cu Cu(NO3)2 + NO + H2O
|
|  2) N-3 N+2 2) N-3 N+2
|  Б. NO + O2 NO2 Б. NO + O2 NO2
|
|  3) N+5 N+2 3) N+5 N+2
|  В. N2 + O2 NO В. N2 + O2 NO
|
| 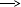 4) N+5 N+4 4) N+5 N+4
|  Г. NH3 + O2 NO + H2O Г. NH3 + O2 NO + H2O
|
|
|  Д. HNO3 +Cu Cu(NO3)2 + NO2 + H2O Д. HNO3 +Cu Cu(NO3)2 + NO2 + H2O
|
12. Концентрированная серная кислота является окислителем в химических реакциях
 1) Cu + H2SO4 CuSO4 + H2O + SO2
1) Cu + H2SO4 CuSO4 + H2O + SO2
 2) CuO + H2SO4 CuSO4 + H2O
2) CuO + H2SO4 CuSO4 + H2O
 3) NaCl + H2SO4 Na2SO4 + HCl
3) NaCl + H2SO4 Na2SO4 + HCl
 4) C + H2SO4 CO2 + H2O + SO2
4) C + H2SO4 CO2 + H2O + SO2
 5) C12H22O11 + H2SO4 CO2 + H2O + SO2
5) C12H22O11 + H2SO4 CO2 + H2O + SO2
13. Напишите полные и сокращённые ионные уравнения возможных химических реакций, в которых оксид углерода(IV) будет взаимодействовать с гидроксидом лития, гидроксидом железа(III), оксидом кальция, водой, хлоридом меди(II).
14. Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
 1) N0 + 3e N-3
1) N0 + 3e N-3
 2) N-3 - 5e N+2
2) N-3 - 5e N+2
 15. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
15. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
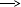

 NaCl HCl ZnCl2 AgCl
NaCl HCl ZnCl2 AgCl
Рассмотрите одно из уравнений химических реакций в свете представлений об электролитической диссоциации.
Вариант II
1. Схема строения иона углерода со степенью окисления –4
1) +14 ) ) )
2 8 4
2) +6 ) )
2 4
3) +6 ) )
2 8
4) +14 ) ) )
2 8 8
2. Положительную степень окисления кислород проявляет в соединении
1) N2O 2) СO 3) OF2 4) Al2O3


 3. В ряду SiO2 P2O5 SO3 Cl2O7 с увеличением относительной молекулярной массы оксидов
3. В ряду SiO2 P2O5 SO3 Cl2O7 с увеличением относительной молекулярной массы оксидов
1) усиливаются основные свойства веществ
2) усиливаются кислотные свойства веществ
3) усиливаются амфотерные свойства веществ
4) свойства веществ практически не изменяются
4. Сера не вступает в химическую реакцию
1) с водородом 3) с металлами
2) с кислородом 4) с водой
5. Соединения азота с металлами называют
1) нитратами 3) нитридами
2) нитритами 4) азотистыми металлами
6. В результате полного сгорания метана образуются
1) углекислый газ и водород 3) углекислый газ и вода
2) углерод (сажа) и вода 4) угарный газ и вода.
7. Сокращённому ионному уравнению
PO43- + 3Ag+ = Ag3PO4
соответствует химическая реакция
1) между фосфатом натрия и хлоридом серебра
2) между фосфатом натрия и нитратом серебра
3) между фосфатом натрия и оксидом серебра
4) между фосфатом натрия и серебром
8. Из приведённых уравнений химических реакций реакцией обмена является
1) (NH4)2CO3 = 2NH3 + CO2 + H2O
2) H3PO4 + 3NaOH = Na3PO4 + 3H2O
3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4) 4P + 5O2 = 2P2O5
9. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, характеризующих свойства аммиака.
|  1) NH3 + H2O 1) NH3 + H2O
| A. N2 + H2O |
|  2) NH3 + H2SO4 2) NH3 + H2SO4
| Б. NO2 + H2O |
| 3) NH3 + O2(недостаток) | В. NH4HSO4 + H2O |
|  4) NH3 + O2(избыток) 4) NH3 + O2(избыток)
| Г. NO + H2O |
|
| Д. NH4OH |
10. Установите соответствие между ионом и способом
его обнаружения в растворах.
| 1) I–
| А. при добавлении щёлочи образуется газ с характерным запахом |
| 2) SO42-
| Б. при добавлении нитрата серебра образуется жёлтый творожистый осадок, нерастворимый в азотной кислоте |
| 3) NO3-
| В. при нагревании с медью и концентрированной серной кислотой образуется голубой раствор и выделяется бурый газ |
| 4) NH4+
| Г. при добавлении нитрата бария выпадает мелкокристаллический осадок, нерастворимый в азотной кислоте |
11. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим её.
|  1) S0 S-2 1) S0 S-2
| t  A. SO2 + H2S S + H2O A. SO2 + H2S S + H2O
|
|  2) S-2 S+4 2) S-2 S+4
| t  Б. S + O2 SO2 Б. S + O2 SO2
|
| 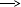 3) S+4 S0 3) S+4 S0
| t  В. S + H2 H2S В. S + H2 H2S
|
|  4) S+4 S+6 4) S+4 S+6
| t  Г. H2S + O2 SO2 + H2O Г. H2S + O2 SO2 + H2O
|
|
| t  Д. H2S + O2 SO2 + H2O Д. H2S + O2 SO2 + H2O
|
|
| t  Е. SO2 + O2 SO3 Е. SO2 + O2 SO3
|
12. Сероводород проявляет свойства восстановителя в химических реакциях
 1) H2S + O2 S + H2O
1) H2S + O2 S + H2O
 2) H2S + NaOH Na2S + H2O
2) H2S + NaOH Na2S + H2O
 3) H2S + SO2 S + H2O
3) H2S + SO2 S + H2O
 4) H2S + Pb(NO3)2 PbS + HNO3
4) H2S + Pb(NO3)2 PbS + HNO3
 5) H2S + O2 SO2 + H2O
5) H2S + O2 SO2 + H2O
13. Напишите полные и сокращённые ионные уравнения химических реакций в тех случаях, где возможно взаимодействие между следующими парами веществ:
 1) SiO2 + O2
1) SiO2 + O2
 2) (NH4)2CO3 + HNO3
2) (NH4)2CO3 + HNO3
 3) SiO2 + H2O
3) SiO2 + H2O
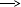 4) Ca(OH)2 + CO2
4) Ca(OH)2 + CO2
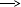 5) SiO2 + HCl
5) SiO2 + HCl
14. Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
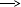 1) N+5 +e N+4
1) N+5 +e N+4
 2) N0 – 2e N+2
2) N0 – 2e N+2
15. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.

 KMnO4 Cl2 Zn AlI3
KMnO4 Cl2 Zn AlI3
Рассмотрите одно из уравнений в свете представлений об окислительно-восстановительных реакциях.
Контрольная работа №3 по теме: «Металлы и их соединения»
Вариант I
1. Как классифицируют металлы: а) по плотности; б) по температуре плавления; в) по твёрдости?
2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
(1) (2) (3) (4)



 Li Li2O LiOH LiNO3 O2
Li Li2O LiOH LiNO3 O2
Реакцию 4 рассмотрите как окислительно-восстановительную.
3. Почему щелочные металлы не применяют для восстановления менее активных металлов, несмотря на то что щелочные металлы очень сильные восстановители?
4. Имеется смесь кальция и оксида кальция массой 100 г. Определите массу кальция, содержащегося в ней, если при действии воды на 2 г такой смеси собрали 224 мл водорода (н. у.).
Вариант II
1. Охарактеризуйте элементы-металлы IIА-группы периодической таблицы химических элементов Д. И. Менделеева по плану: а) строение атома; б) изменение металлических свойств; в) формулы оксидов и гидроксидов.
2. Напишите уравнение реакции получения железа восстановлением из его оксида Fe2O3 водородом и углеродом. Укажите окислитель и восстановитель.
3. Составьте уравнения реакций, соответствующих приведённым схемам:

 а) H2SO4(р-р) + Zn в) Cu + AgNO3(р-р)
а) H2SO4(р-р) + Zn в) Cu + AgNO3(р-р)

 б) Li + O2 г) Ca + P
б) Li + O2 г) Ca + P
Реакцию г) разберите как окислительно-восстановительную.
4. 10,2 г технического образца магния обработали избытком раствора серной кислоты. При этом выделилось 7,48 л газа (н. у.). Вычислите массовую долю (в %) магния в образце.
Контрольная работа № 4 по теме: «Органические соединения»
Вариант I
1. Общая формула одноатомных предельных спиртов
1) CnH2n 2) CnH2n + 2 3) CnH2n – 2 4) CnH2n + 1OH
2. Ряд, в котором находятся формулы только карбоновых кислот, — это
1) C2H4, C2H5OH, C2H5COOH
2) C2H5COOH, C3H7COOH, CH3COOH
3) C2H5OH, CH3COOH, C2H5COOH
4) CH3COOH, C2H5OH, C3H7OH
3. Гомологи — это
1) этан и этилен
2) метан и ацетилен
3) пропан и пропанол
4) муравьиная кислота и уксусная кислота
4. Сжигание природного газа при недостатке воздуха
приводит к образованию ядовитого газа
1) CO2 2) CO 3) H2O 4) N2
5. Реактивом на ацетилен является
1) Br2 (р-р) 3) иод
2) соляная кислота 4) гидроксид меди(II)
6. Впишите нужную формулу органического вещества в схему химической реакции
 … + Mg (CH3COO)2Mg + H2
… + Mg (CH3COO)2Mg + H2
1) CH3OH 3) CH3CH2COOH
2) CH3COOH 4) CH3CH2OH
7. Полиэтилен получают полимеризацией этилена. В этой реакции
1) этилен — мономер, а полиэтилен — полимер
2) этилен — полимер, а полиэтилен — мономер
3) этилен и полиэтилен — полимеры
4) этилен и полиэтилен — мономеры
8. Укажите, какие из представленных формул веществ выражают состав гомологов.
9. Установите соответствие между названием органического вещества и классом органических соединений, к которому оно принадлежит.
| 1) этан | А. спирты |
| 2) метанол | Б. углеводы |
| 3) глюкоза | В. аминокислоты |
| 4) глицин | Г. алканы |
10. Вставьте в схемы химических реакций недостающие формулы веществ.
1) … + … = HCOONa + H2O
2) … + … = (HCOO)2Mg + H2
3) … + … = HCOOCH3 + H2O
4) … + … = CH3COOC2H5 + H2O
11. При гидрировании этилена объёмом 22 л получено 20 л этана (н. у.). Рассчитайте объёмную долю выхода этана.
Вариант II
А-1. Общая формула одноосновных предельных карбоновых кислот
1) CnH2n 3) CnH2n – 2
2) CnH2n + 1 4) CnH2n + 1COOH
А-2. Ряд, в котором находятся формулы только карбоновых кислот, — это
1) C2H4, C2H5OH, C2H2
2) C2H5OH, C3H7OH, CH3OH
3) C2H5OH, CH3OH, C2H6
4) CH3COOH, C2H5СОOH, C3H7СОOH
А-3. Гомологи — это
1) этан и этилен 3) метанол и пропанол
2) метан и ацетилен 4) этилен и этанол
А-4. Реактивом на крахмал является
1) Br2(р-р) 3) иод
2) раствор перманганата калия 4) гидроксид калия
А-5. Впишите нужную формулу органического вещества в схему химической реакции
… + Na = C2H5ONa + H2
1) CH3OH 2) C2H6O 3) C2H5OH 4) C3H7OH
А-6. При горении метанола образуются
1) СО и Н2 3) СО2 и Н2
2) СО2 и Н2О 4) СО и Н2О
А-7. Реакции полимеризации соответствует уравнение
 1) CH2 =CH2 + H2 CH3— CH3
1) CH2 =CH2 + H2 CH3— CH3
 2) CH3— CH3 + Cl2 CH3— CH2Cl + HCl
2) CH3— CH3 + Cl2 CH3— CH2Cl + HCl
 3) CH2= CH2 + HCl CH3 — CH2Cl
3) CH2= CH2 + HCl CH3 — CH2Cl
 4) nCH2 =CH2 (— CH2 — CH2 — )n
4) nCH2 =CH2 (— CH2 — CH2 — )n
В-1. Укажите, какие из представленных формул веществ
выражают состав гомологов.
В-2. Установите соответствие между названием органического вещества и классом органических соединений, к которому оно принадлежит.
| 1) уксусная кислота | А. сложные эфиры |
| 2) этилацетат | Б. углеводы |
| 3) крахмал | В. аминокислоты |
| 4) глицин | Г. карбоновые кислоты |
В-3. Вставьте в схемы химических реакций недостающие
формулы веществ.
1) … + … = CH3COONa + H2O
2) … + … = (CH3COO)2Ca + H2
3) … + … = CH3COOCH3 + H2O
4) … + … = HCOOC2H5 + H2O
C-1. Вычислите объёмы (н. у.) кислорода и воздуха, которые потребуются для полного сжигания 1 м3 природного газа, содержащего 5 % этилена.







 Zn + H2SO4
Zn + H2SO4  Cu + HCl
Cu + HCl  Pb2+ + 2OH-= Pb(OH)2
Pb2+ + 2OH-= Pb(OH)2  CO2-3 + 2H+ = H2O +CO2
CO2-3 + 2H+ = H2O +CO2 
 4) N+5 N+4
4) N+5 N+4









