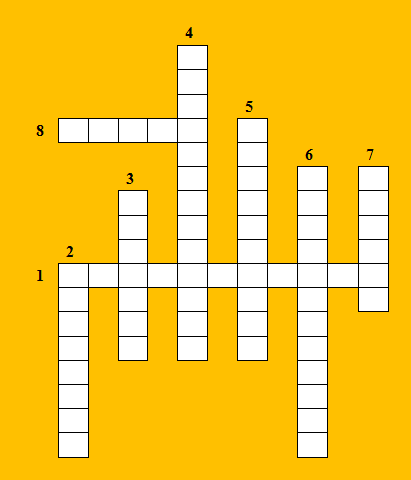Михайловский филиал ГАПОУ "Волгоградский медицинский колледж"
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
КОМБИНИРОВАННОГО
ЗАНЯТИЯ
Тема: Химическая связь и строение молекул
Общеобразовательная учебная дисциплина Химия
Курс: 1
Специальность: Сестринское дело
Форма обучения: очная
Количество часов: 2
Разработчик: Анкудинова Н.Н.
Методическая разработка
рассмотрена и одобрена
на заседании УМО
Протокол____от_______
Председатель УМО ________________
Михайловка, 2016
Мотивация изучения темы Понятие о химической связи и строении молекул является основополагающим в изучении курса общей и неорганической химии, позволяет формировать целостную картину мира веществ, прививать интерес к химии, как важнейшего компонента медицинских знаний.
Цели занятия:
Учебные цели студент должен
знать причины многообразия веществ, понятия электронных орбиталей, способы их перекрывания, типы химических связей, механизм образования ковалентной связи (неполярной, полярной);
уметь моделировать строение молекул веществ с ковалентной и ионной связью, владеть основополагающими химическими понятиями, теориями, законами и закономерностями, уверенно пользоваться химической терминологией и символикой.
Способствовать формированию представлений о месте химии в современной научной картине мира.
Способствовать проявлению студентами логического мышления.
Создать условия для понимания роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач.
Развивающие цели
Обеспечить развитие познавательных интересов и интеллектуальных способностей в процессе моделирования химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями
Способствовать формированию мировоззрения, соответствующего современному уровню развития науки и общественной практики; основ саморазвития, самообразования и самовоспитания
Формировать готовность и навыки сотрудничества со сверстниками и взрослыми в образовательной деятельности; умение самостоятельно определять цели деятельности и составлять планы деятельности; готовность и способность к самостоятельной информационно-познавательной деятельности, владение навыками получения необходимой информации
Воспитательные цели
Способствовать принятию и реализации ценностей здорового и безопасного образа жизни; бережному, ответственному и компетентному отношению к физическому и психологическому здоровью
Формировать умение выбирать успешные стратегии в различных ситуациях; навыки разрешения проблем; критически оценивать и интерпретировать информацию, получаемую из различных источников; умение самостоятельно оценивать и принимать решения, определяющие стратегию поведения, с учетом гражданских и нравственных ценностей;
Формируемые результаты учебной деятельности
сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
владение основными методами научного познания, используемыми в химии: наблюдение, описание, измерение, эксперимент; готовность и способность применять методы познания при решении практических задач;
сформированность умения давать количественные оценки и проводить расчеты по химическим формулам и уравнениям;
владение правилами техники безопасности при использовании химических веществ;
сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Интеграционные связи внутридисциплинарные «Строение атома», «Периодический закон и периодическая система Д.И. Менделеева»
Формы организации учебной деятельности студентов фронтальная, индивидуальная, коллективная
Применяемые на занятии технологии обучения проблемное обучение, личностноориентированное обучение, деятельностные технологии
Применяемые на занятии методы обучения
по источнику информации: словесные, наглядные
по степени активности обучаемых: действие по образцу, работа в парах, микрогруппах
Оснащение учебник, раздаточный материал
Основные этапы занятия с указанием хронометража
Орг.момент 2 минуты
Проверка знаний и умений 8 минут
Объяснение нового материала 25 минут
Закрепление вновь изученного 10 минут
Обобщение изученного материала 38 минут
Подведение итогов занятия 5 минуты
Домашнее задание 2 минуты
Список литературы
Кузменко Н.Е. Сборник задач и упражнений по химии. /Н.Е. Кузьменко, В.В. Еремин.-М.: Экзамен, 2002.-544 с.
Пустовалова Л.М. Общая химия. / Л.М. Пустовалова, И.Е. Никанорова. – Ростов н/Д : Феникс, 2006. – 478 с.
Ход занятия
| № п/п | Название этапа | Описание этапа | Педагогическая цель этапа | Продолжительность этапа |
|
| Орг. момент | Отмечаются отсутствующие и внешний вид студентов и аудитории, сообщается тема, цели с проведением мотивации, сообщается план проведения занятия | Создание рабочей атмосферы, формирование познавательного интереса к учебной деятельности по данной теме, дисциплинирование обучающихся, мотивация | 2 |
|
| Проверка знаний и умений | а). проверка знаний по темам Строение атома, структура периодической системы Д.И. Менделеева. Фронтальная беседа Основные положения атомно-молекулярной теории История становления представлений о строении атома Строение атома, квантовые числа Понятие электронной орбитали Типы электронных орбиталей и формы соответствующих облаков Строение периодической системы Закономерности изменения свойств элементов в периодической системе Современная формулировка периодического закона Способы перекрывания электронных облаков
б). подведение итогов контроля: Преподаватель обращает внимание на допущенные ошибки, вносит коррективы в ответы, отмечает лучших студентов и дает рекомендации, пояснения тем, кто допустил ошибки. | Определение уровня усвоения изучаемого материала, выявление слабых мест. | 8 |
|
| Объяснение нового материала | Сообщение обучающимся новых знаний. Организация самостоятельного изучения нового учебного материала с использованием раздаточного материла (Приложение 1), записи в тетрадях по плану: | Формирование познавательного интереса к данной теме, побуждение к самостоятельной деятельности, помощь в осмыслении действий. | 25 |
|
| Закрепление | Закрепление пройденного материала; уточнение, обобщение и систематизация полученных знаний. Работа в парах, выполнение заданий и взаимоконтроль. Используя раздаточный материал, записи в тетрадях, информацию в учебнике определите тип химической связи в следующих соединениях. Ответ поясните. Вариант 1. CsCl, CH4, Na, O2 Вариант 2. Mg, KF, H2S, P | Определение уровня усвоения изучаемого материала, выявление слабых мест. Формирование практических умений, необходимых для овладения последующими учебными дисциплинами. Выработка умений самостоятельной работы по данной теме. | 10 |
|
| Обобщение изученного материала | Закрепление и обобщение материала по типам химических связей и механизму их образования. Работа в микрогруппах по выполнению комплекса заданий (Приложение2). Проверка выполненных заданий, оценивание эффективности работы в группе. | Обобщение и систематизация знаний. Выработка умений работать в микро и макрогруппах. Формирование творческого и логического мышления. | 38 |
|
| Подведение итогов занятия | Преподаватель кратко анализирует занятие и дает критическую оценку каждого его этапа, обращает внимание на хорошие результаты и на допущенные ошибки, выделяет лучшие работы и указывает на отставание, недостаточную подготовленность к занятию. Проверяет и оценивает учебные записи студентов, в соответствии с показателями и критериями, указанными в методических рекомендациях по управлению | Побуждение студентов к рефлексии, стимулирование интереса к учебе и ее результатам | 5 |
|
| Задание на дом | Преподаватель дает четкие рекомендации по подготовке к следующему занятию, (учебник Общая химия Л. М. Пустовалова, стр 38-53, Химическая связь), акцентируя внимание на главных вопросах | Обеспечение добросовестного и осознанного выполнения домашнего задания. | 2 |
Приложение 1
Химическая связь. Строение вещества.
Разные вещества имеют различное строение. Из всех известных на сегодняшний день веществ только инертные газы существуют в виде свободных (изолированных) атомов, что обусловлено высокой устойчивостью их электронных структур. Все другие вещества (а их в настоящее время известно более 10 млн) состоят из связанных атомов.
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток.
По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром. При переходе от атомного состояния к молекулярному происходит выделение энергии, связанное с заполнением электронами свободных орбиталей внешнего электронного уровня до определенного устойчивого состояния.
Существуют различные виды химической связи.
Ковалентная связь – это химическая связь, осуществляемая за счет обобществления электронных пар. Теорию ковалентной связи предложил в 1916 г. американский ученый Гилберт Льюис. За счет ковалентной связи образуется большинство молекул, молекулярных ионов, свободных радикалов и атомных кристаллических решеток. Ковалентная связь характеризуется длиной (расстояние между атомами), направленностью (определенная пространственная ориентация электронных облаков при образовании химической связи), насыщаемостью (способность атомов образовывать определенное число ковалентных связей), энергией (количество энергии, которое необходимо затратить для разрыва химической связи).
Ковалентная связь может быть неполярной и полярной. Неполярная ковалентная связь возникает между атомами с одинаковой электроотрицательностью (ЭО) (H2, O2, N2 и т. д.). В этом случае центр общей электронной плотности находится на одинаковом расстоянии от ядер обоих атомов. По числу общих электронных пар (т.е. по кратности) различают одинарные, двойные и тройные ковалентные связи. Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется одинарной. Если между двумя атомами возникают две или три общие электронные пары, образуются кратные связи – двойные и тройные. Двойная связь состоит из одной  -связи и одной
-связи и одной  -связи. Тройная связь состоит из одной
-связи. Тройная связь состоит из одной  -связи и двух
-связи и двух  -связей.
-связей.
Ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов, называются  -связями. Ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов, называются
-связями. Ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов, называются  -связями.
-связями.
В образовании  -связей могут участвовать s- и s-электроны (Н2), s- и p-электроны (HCl), р- и р-электроны (Cl2). Кроме того,
-связей могут участвовать s- и s-электроны (Н2), s- и p-электроны (HCl), р- и р-электроны (Cl2). Кроме того,  -связи могут образовываться за счет перекрывания «чистых» и гибридных орбиталей. В образовании
-связи могут образовываться за счет перекрывания «чистых» и гибридных орбиталей. В образовании  -связей могут участвовать только р- и d-электроны.
-связей могут участвовать только р- и d-электроны.
Ниже линиями показаны химические связи в молекулах водорода, кислорода и азота:
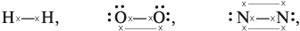
где пары точек (:) – спаренные электроны; «крестики» (х) – неспаренные электроны.
Если ковалентная связь образуется между атомами с различной ЭО, то центр общей электронной плотности смещен в сторону атома с большей ЭО. В этом случае имеет место ковалентная полярная связь. Двухатомная молекула, связанная ковалентной полярной связью, представляет собой диполь – электронейтральную систему, в которой центры положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга.
Графический вид химических связей в молекулах хлороводорода и воды следующий:

где стрелками показано смещение общей электронной плотности.
Полярная и неполярная ковалентные связи образованы по обменному механизму. Кроме того, существуют донорно-акцепторные ковалентные связи. Механизм образования их другой. В этом случае один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором). Акцептор при образовании такой связи предоставляет свободную электронную орбиталь.
Донорно-акцепторный механизм образования ковалентной связи проиллюстрирован на примере образования иона аммония:

Таким образом, в ионе аммония все четыре связи являются ковалентными. Три из них образованы по обменному механизму, одна – по донорно-акцепторному. Все четыре связи равноценны, что обусловлено sp3-гибридизацией орбиталей атома азота. Валентность азота в ионе аммония равна IV, т.к. он образует четыре связи. Следовательно, если элемент образует связи и по обменному, и по донорно-акцепторному механизмам, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. Для азота, в частности, высшая валентность равна четырем.
Ионная связь – химическая связь между ионами, осуществляемая за счет сил электростатического притяжения. Ионная связь образуется между атомами, имеющими большую разность ЭО ( 1,7); другими словами, это связь между типичными металлами и типичными неметаллами. Теория ионной связи была предложена в 1916 г. немецким ученым Вальтером Косселем. Отдавая свои электроны, атомы металлов превращаются в положительно заряженные ионы – катионы; атомы неметаллов, принимая электроны, превращаются в отрицательно заряженные ионы – анионы. Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионная связь характеризуется ненаправленностью и ненасыщаемостью; для ионных соединений понятие «молекула» не имеет смысла. В кристаллической решетке ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным зарядом. Для соединений NaCl и FeS характерна кубическая кристаллическая решетка.
| 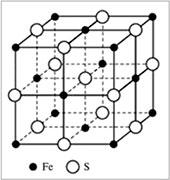
|
| Ионная кристаллическая решетка сульфида железа FeS |
Ниже показано образование ионной связи на примере хлорида натрия:
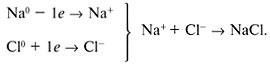
Ионная связь является крайним случаем полярной ковалентной связи. Резкой границы между ними не существует, тип связи между атомами определяется по разнице электроотрицательности элементов.
При образовании простых веществ – металлов – атомы достаточно легко отдают электроны внешнего электронного уровня. Таким образом, в кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки находятся положительно заряженные ионы и атомы металлов, а между ними – электроны, которые могут свободно перемещаться по всей кристаллической решетке. Эти электроны становятся общими для всех атомов и ионов металла и называются «электронным газом». Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называетсяметаллической связью.
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электропроводность, теплопроводность, ковкость, пластичность, металлический блеск. Свободные электроны могут переносить теплоту и электричество, поэтому они являются причиной главных физических свойств, отличающих металлы от неметаллов, – высокой электро- и теплопроводности.
Водородная связь возникает между молекулами, в состав которых входит водород и атомы с высокой ЭО (кислород, фтор, азот). Ковалентные связи H–O, H–F, H–N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах – избыточный отрицательный заряд. Между разноименно заряженными полюсами возникают силы электростатического притяжения – водородные связи. Водородные связи могут быть как межмолекулярными, так и внутримолекулярными. Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.

Таблица
| Особенность кристаллической решетки | Тип кристаллической решетки |
| Молекулярная | Ионная | Атомная | Металлическая |
| Частицы в узлах решетки | Молекулы | Kатионы и анионы | Атомы | Kатионы и атомы металлов |
| Характер связи между частицами | Силы межмолекулярного взаимодействия (в том числе водородные связи) | Ионные связи | Kовалентные связи | Металлическая связь |
| Прочность связи | Слабая | Прочная | Очень прочная | Разной прочности |
| Отличительные физические свойства веществ | Легкоплавкие или возгоняющиеся, небольшой твердости, многие растворимы в воде | Тугоплавкие, твердые, многие растворимы в воде. Растворы и расплавы проводят электрический ток | Очень тугоплавкие, очень твердые, практически нерастворимы в воде | Высокая электро- и теплопроводность, металлический блеск |
| Примеры веществ | Йод, вода, сухой лед | Хлорид натрия, гидроксид калия, нитрат бария | Алмаз, кремний, бор, германий | Медь, калий, цинк, железо |
Межмолекулярные водородные связи между молекулами воды и фтороводорода можно изобразить (точками) следующим образом:

Вещества с водородной связью имеют молекулярные кристаллические решетки. Наличие водородной связи приводит к образованию ассоциатов молекул и, как следствие, к повышению температур плавления и кипения.
Кроме перечисленных основных видов химической связи существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти взаимодействия называются вандерваальсовыми силами. Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Различные виды химической связи обусловливают существование различных типов кристаллических решеток (табл.).
Вещества, состоящие из молекул, имеют молекулярное строение. К таким веществам относятся все газы, жидкости, а также твердые вещества с молекулярной кристаллической решеткой, например йод. Твердые вещества с атомной, ионной или металлической решеткой имеют немолекулярное строение, в них нет молекул.
| 
|
| Молекулярная кристаллическая решетка йода I2 |
Приложение 2
Задание «Крестики-нолики»: «Соедините прямой линией по горизонтали, вертикали или диагонали три клетки, которые содержат формулы веществ с типом химической связи»:
а) ковалентная неполярная
| CF4 | KI | O3 |
| C60 | I2 | Mg3N2 |
| Cl2 | NaCl | NaNO2 |
Ответ: Cl2 – I2– O3.
б) ионная
| KNO3 | Se | H2S |
| MgF2 | Cs2O | NaF |
| SO2 | HCl | N2O |
Ответ: MgF2 – Cs2O – NaF.
в) металлическая
| K | C2H5OH | NO2 |
| O2 | C60 | F2 |
| Zn | Au | Rb |
Ответ: Zn – Au – Rb.
г) ковалентная полярная
| Cl2O | H3PO4 | Na2O2 |
| Li3N | N2O3 | LiOH |
| H2Se | P4 | CS2 |
Ответ: Cl2O – N2O3 – CS2.
д) смешанный тип связи
| PH4OH | Na3N | Sr(OH)2 |
| H2SO3 | KClO | HNO2 |
| Ca(ClO)Cl | Cl2O7 | As |
Ответ: Ca(ClO)Cl – KClO – Sr(OH)2.
Задание «Кто точнее»: «Определите по формуле вещества тип химической связи, используя обозначения, приведенные ниже».
| 1 вариант | H2SiO3 | SO2 | Br2 | Pt | K2SO4 |
| O3 | CaO | N2H4 | Hg | BaBr2 |
| 2 вариант | Cr | N2O | PH3 | H2Se | CS2 |
| RbOH | I2 | CO | NH4OH | LiI |
Задание 3 «Кроссворд»: «Решите кроссворд:
1 – образование химической связи обусловлено взаимодействием атомных частиц и сопровождается … электронных оболочек (орбиталей) внешнего энергетического уровня; 2 – вид химической связи, образующийся в сложных веществах между атомными частицами неметаллов;
3 – количество теплоты, поглощаемое при разрыве связи или выделяемое при ее образовании;
4 – вид химической связи, образующийся в простых металлических веществах;
5 – вид химической связи, образующийся в простых веществах между частицами неметаллов;
6 – в виде свободных (изолированных) атомов существуют только благородные газы (гелий, неон, аргон, криптон, ксенон и радон), что обусловлено высокой … их электронных структур;
7 – вид химической связи, образующийся в сложных веществах между атомными частицами металлов и неметаллов;
8 – расстояние между ядрами связываемых атомных частиц».
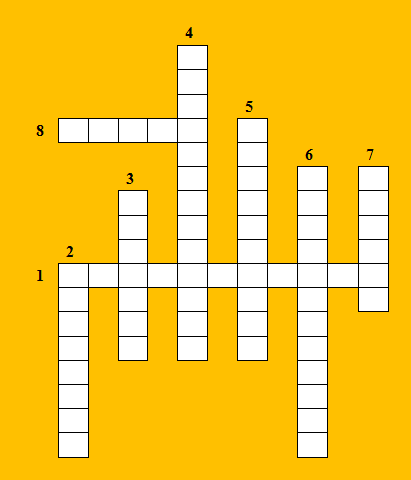
Задание 4
Тест (1-ый уровень)
1.Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера; в) калий и кислород;
б) водород и азот; г) кремний и водород.
2. Формула вещества с ковалентной полярной связью:
а) NaCl; б) HCl; в) ВаО; г) Ca3N2.
3. Формула вещества с ковалентной неполярной связью:
а) Na; б) Br2 ; в) HBr ; г) KCl.
4.Наименее полярной является связь:
а) С – Н ; б) С – Cl ; в) С – F ; г) С – Вr .
5. Наиболее прочной является молекула:
а) Н2; б) N2; в) F2; г) О2.
6. Атомную кристаллическую решетку имеет:
а) сода; б) вода; в) алмаз; г) парафин.
7. Атом углерода имеет степень окисления -3 и валентность IV в соединении с формулой:
а) СО2; б) С2Н6; в) СН3Cl; г) СаС2.
8. Вещество, между молекулами которого существует водородная связь:
а) этан; б) фторид натрия; в) оксид углерода (II); г) этанол.
9. Причины резкого различия свойств воды и сероводорода заключаются в особенностях:
а) внутримолекулярной связи; б) межмолекулярной связи.
Тест (2-ой уровень)
1. Формула вещества с ионной связью:
а) NH3; б) С2Н4; в) KH; г) ССl4.
2. Ковалентная неполярная связь образуется между атомами:
а) водорода и кислорода; в) водорода и хлора;
б) водорода и фосфора; г) магния.
3. Наиболее полярной является связь:
а) Н – С; б) Н – О; в) Н – S; г) Н – I .
4.Число сигма и пи связей в веществе пропен соответственно:
а) 7- сигма, 2-пи; в) 6- сигма, 2-пи
б) 8-сигма, 1-пи; г) 8-сигма, 2-пи.
5. Наиболее прочные связи в молекуле вещества, формула которого:
а) Н2 S; б) Н2 Sе; в) Н2 О; г) Н2Те.
6. Атом азота имеет валентность III и степень окисления 0 в молекуле вещества, формула которого:
а) ) NH3 ; б) N2 ; в) CH3NO2; г) N2 O3.
7. Молекулярное строение имеет вещество с формулой:
а) СН4 ; б) NаОH; в) SiO2; г) Al.
8. Водородная связь образуется между:
а) молекулами воды; в) молекулами водорода;
б) молекулами углеводородов; г) атомами металлов и атомами водорода.
9. Какая связь обладает направленностью:
а) ионная; б) ковалентная; в) металлическая.
Тест (3-ий уровень)
1. Химические связи в веществах, формулы которых СН4 и CaCl2 соответственно:
а) ионная и ковалентная полярная;
б) ковалентная полярная и ионная;
в) ковалентная неполярная и ионная;
г) ковалентная полярная и металлическая.
2. Полярность связи больше в веществе с формулой:
а) Br2; б) LiBr; в) HBr; г) KBr.
3. Ионный характер связей в ряду соединений
Li2O - Na2O – K2O – Rb2O:
а) увеличивается; в) не изменяется;
б) уменьшается; г) сначала уменьшается, потом увеличивается.
4. Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в веществе, формула которого:
а) Al(OH)3; б) [CH3NH3]Cl; в) C2H5OH; г) C6H12O6.
5. Пара формул веществ, в которых есть только сигма-связи:
а) СН4 и O2 ; б) C2H5OH и Н2O; в) N2 и СO2; г) HBr и С2Н4
6. Наиболее прочная связь из приведенных:
а) C – Cl; б) C – F; в) C – Br; г) C – I .
7. Валентность и степень азота в хлориде аммония соответственно равны:
а) IV и +4; б) IV и -2; в) III и +2; г) IV и -3.
8. Общее свойство у веществ с молекулярной кристаллической решеткой:
а) растворимость в воде; в) электропроводность растворов;
б) высокая температура кипения; г) летучесть.
9. Образованием водородных связей можно объяснить:
а) растворимость уксусной кислоты в воде;
б) кислотные свойства этанола;
в) высокую температуру плавления многих металлов;
г) нерастворимость метана в воде.