Тема урока: «Реакции разложения»
Цель: Изучить механизм реакций разложения. Познакомиться с понятиями «катализатор», «фермент». Отработать навыки составлять уравнения химических реакций.
Задачи:
1. Образовательные - развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, определять реакции разложения., делать выводы и обобщения.
2. Развивающие - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
3. Воспитательные - воспитание самостоятельности, сотрудничества, нравственных качеств – коллективизма, способности к взаимовыручке, адекватной самооценке.
Тип урока:Комбинированный,. Приобретение новых знаний
Вид урока: Проблемно-развивающий
Вид урока.Беседа с демонстрацией опытов.
Методы и методические приемы.
Фронтальный опрос, беседа, демонстрация опытов, работа в группах. Демонстрация видеоролика, метод парной работы, взаимопроверка, самостоятельная работа.
Оборудование и реактивы:
Компьютер, проектор, лабораторное оборудование для опытов.
На столе учителя:
бихромат аммония,пероксид водорода основной карбонат меди (II), . бутылка с газированной водой
На столах учеников:, пероксид водорода, оксид марганца (IV), сырой картофель; Пробирки, спиртовки, держатель, лучинка, спички.
Перед уроком уч-ки заходят в класс без портфелей , только с ручками. и выбирают себе кружочек любого цвета(красный , зеленый, синий) по этому принципу формируются группы . Дети рассаживаются за столы , где круг того же цвета.. всего 17
На столах уже приготовлены реактивы и рабочие листы для каждого .
Ход урока:
Эпиграф: слайд1
“Дорога к знаниям? Ну что ж её легко понять,
Ответить можно сразу:
Вы ошибаетесь, и ошибаетесь опять,
Но меньше, меньше, меньше с каждым разом”.
Здравствуйте ребята, меня зовут Ольга Васильевна , и мне приятно, что это время я проведу вместе с вами.
-Ребята , с какими явлениями природы вы знакомы(физические , химические) слайд 2
-Что представляют собой физические и химические явления? слайд 3
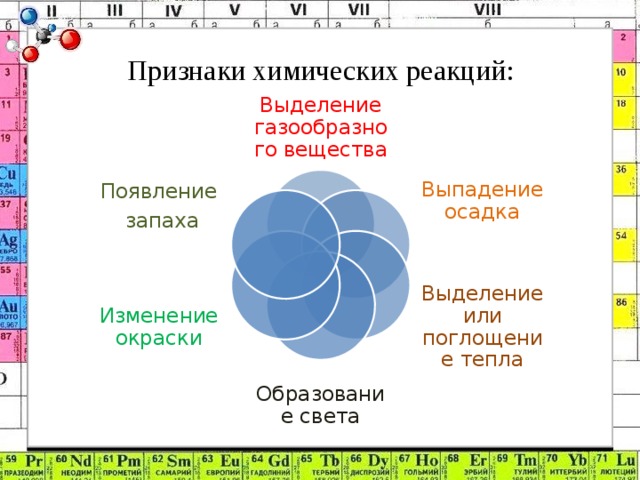
-По каким признакам мы определяем химические явления? слайд 4
Ребята для каждого из вас на столе приготовлены рабочие листы №1 №2 в течение всего урока мы будем в них работать.
Найдите задание №1. Прочтите и ответьте на вопросы за 1 минуту.
Итак , готовы ?
1 группа читает 1-й вопрос и отвечает.
2 группа читает 2 й вопрос и отвечает .
3группа читает 3 вопрос и отвечает
Вопросы группам
1.Какие условия протекания реакции вам известны?
2.Как еще называют химические явления?
3.Приведите примеры химических явлений.
Хорошо , молодцы.
А сейчас мы посетим химическую лабораторию..
Внимательно смотрите и слушайте. В этом видеоролике скрыта тема нашего урока
Слайд 5. видеоопыт «Электролиз воды», после просмотра задает вопросы:
Ребята , кто догадался, какая же тема нашего урока ?
Учащиеся отвечают: реакции разложения. Слайд 6
Запишите разложение воды на доске, в виде химической реакции.
И в свой рабочий лист
Еще раз посмотрите на свои рабочие листы и скажите , что мы должны будем знать и уметь к концу этого урока?(Отвечают дети)
Учитель: Ребята . а кто знает сказку «Малахитовая шкатулка»?А кто автор этой сказки?
-Павел Петрович Бажов.
А вы знаете , что малахит это минерал ,который легко разлагается при нагревании .
Давайте убедимся.
-Сейчас я попрошу одного ученика выйти ко мне и провести реакцию разложения малахита. ( напоминаем правила техники безопасности в хим. Кабинете
Х имическая формула малахита(CuOH)2CO3 CuO+ H20+ CO2 слайд 7
имическая формула малахита(CuOH)2CO3 CuO+ H20+ CO2 слайд 7
Обсуждают признаки (изменение цвета и выделение газа) и записывают уравнение на доске.и в рабочем листе
Учитель: Ребята, а вы любите географию? Кто знает, где находятся Курильские острова ?
между полуостровом Камчатка и островом Хоккайдо.
В районе Курильских островов насчитывается 68надводных вулканов .Из них 37 действующих.
слайд 8
Учитель показывает опыт «Вулкан»: разложение бихромата аммония и записывает на доске формулу этого вещества.
Учащиеся сами составляют формулы образовавшихся веществ, записывают уравнение на доске.
Учитель: Итак, ребята на доске у нас 3 уравнения реакции разложения. Попробуйте дать определение, какие реакции называют реакциями разложения.
Учащиеся отвечают на вопрос и проверяют себя по слайду. Слайд9
И записывают в рабочий лист.
Учитель:
Ребята , кто знает что такое пероксид водорода или перекись водорода?
-Бесцветная жидкость, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны.
Где она применяется? слайд 10
Перекись водорода применяется достаточно широко .
- в медицине-для лечения инфекционных заболеваний,
стоматита, , кариеса, кожных болезней и много других.
Использовать перекись водорода можно и в повседневной жизни, быту, кулинарии и сельском хозяйстве
Учитель: Ребята, следующий опыт, который я вам покажу это разложение пероксида водорода.
Кратко характеристика опыта( мне понадобится перекись водорода,аммиакат меди и моющее средство )
-Какое вещество изменило скорость реакции? (аммиакат меди)
Как называются такие вещества?
-Катализаторы.
А теперь самостоятельно вы проведете еще один опыт разложение пероксида водорода.
Техника безопасности на уроке
Сначала его нагрейте. Идет реакция? (Очень медленно). Добавьте в пробирку с пероксидом водорода оксид марганца (IV). Что наблюдаете? (Выделение газа). Проверяем тлеющей лучинкой, она ярко вспыхивает. Значит, образовавшийся газ – это кислород. Записываем уравнение реакции разложения пероксида водорода на доске. И в рабочий лист
Какое вещество выступило в роли катализатора?
-оксид марганца.
А вы мне верите, что вместо оксида марганца (IV) можно положить кусочек сырого картофеля, реакция тоже пойдет быстрее? Давайте проверим. (Учащиеся сами проводят опыт)
Значит, в сырых овощах есть катализаторы – вещества белковой природы.
А как называются такие вещества? (Ферменты) слайд 11
(Учитель показывает таблетки «Фестал», «Панкреатин», задает вопрос ученикам: «Что это такое? Для чего они нужны?»)
Учитель: Раз мы принимаем их во время приема пищи, значит внутри нас идут химические реакции; наш организм сам вырабатывает ферменты. Вы можете проверить это дома.
Нужно разжевать кусочек черного хлеба, и подержать во рту вы
почувствуете, Изменение вкуса хлеба, появление сладкого привкуса во рту.
Учитель: Итак, сегодня мы познакомились с реакциями разложения, одни идут под действием электрического тока, другие – при нагревании, третьи – под действием катализаторов.
А есть ли такие реакции, которые протекают без всяких условий?
(Учитель достает бутылку с газированной водой, открывает крышку, и учащиеся наблюдают, что реакция идет самопроизвольно).
Закрепление полученных знаний
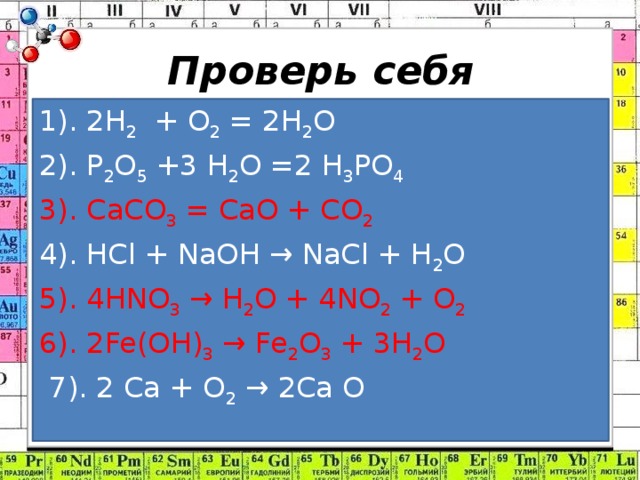
В рабочих листах найдите задание №5 и выполните его самостоятельно.
Упражнение на рабочем листе. Даны схемы химических реакций:
1).2H2 + O2 = 2H2O
2).P2O5 + H2O = H3PO4
3).CaCO3 = CaO + CO2
4).HCl + NaOH → NaCl + H2O
5). 4HNO3 →2 H2O +4 NO2 + O2
6).2Fe(OH)3 → Fe2O3 + 3H2O
7). 2Ca + O2 → 2CaO
Отметь реакции разложения. Под какими цифрами написаны реакции разложения
Учитель: а теперь поменяйтесь листами и проверьте друг у друга правильность выполнения.
Сверьте свои ответы с ответами на экране.
Итог урока
Рефлексия слайд 12
Резерв 2 опыта
Это самый простой и безопасный способ получения глюконатной змеи - для этого достаточно поднести к пламени таблетку глюконата кальция, который продается в каждой аптеке. Можно положить таблетку глюканата кальция на таблетку сухого спирта и поджечь его. Из таблетки выползет светло-серая "змея" с белыми пятнами, объем которой намного превышает объем исходного вещества - она может достигнуть длины 10-15 см.
Разложение глюконата кальция, имеющего состав Са[CH2OH(CHOH)4COO]2 · H2O приводит к образованию оксида кальция, углерода, углекислого газа и воды.
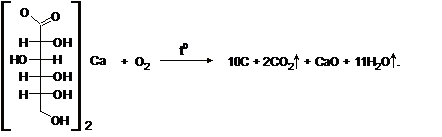
Разложение пероксида водорода
"В коническую колбу на 300 мл налейте 10-20 мл жидкого моющего средства для посуды Gala (или любого аналогичного моющего средства). В другой колбочке растворите 3-4 гр сульфата меди в избытке крепкого раствора аммиака (добавляйте аммиак, пока сульфат меди полностью не растворится). Образуется синий аммиакат меди (II):
CuSO4 + 6NH3 + 2H2O = [Cu(NH3)4](OH)2 + (NH4)2SO4
Вылейте раствор аммиаката меди в колбу с моющим средством и хорошо перемешайте. Поставьте колбу на стол и быстро добавьте в нее 50-100 мл 30-50% раствора перекиси водорода. Произойдет сильное выделение газа. Из колбы ударит фонтан пены. Все пространство вокруг колбы за несколько секунд заполнится большим комком пены. От пены будет подниматься пар - реакция разложения перекиси водорода протекает с выделением тепла. В наших экспериментах высота и ширина образовавшейся пены была около 60 см."





 имическая формула малахита(
имическая формула малахита(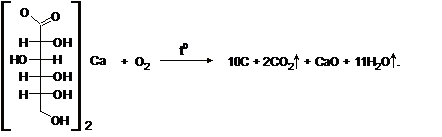
 ____
____

 (
(