Практическая работа
Решение расчетных задач на вычисление количества вещества
по массе и объему. Число Авогадро.
Цель работы: совершенствование умений производить простейшие расчеты по формулам, связывающим физические величины: «масса», «молярная масса», «объём», «молярный объём», «число частиц», «количество вещества», «постоянная Авогадро».
Задачи работы:
- закрепить понятия «молярная масса», «молярный объем»;
- закрепить умения производить простейшие вычисления по расчетным формулам.
Теоретическая часть по теме:
Моль, молярная масса. В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро.
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль любого вещества содержит 6,02 • 1023 частиц этого вещества. NА = 6,02 • 1023 моль-1.
Например: 1 моль кислорода содержит 6,02 • 1023 молекул O2.
1 моль серной кислоты содержит 6,02 • 1023 молекул H2SO4.
1 моль серы содержит 6,02 • 1023 атомов S.
2 моль серы содержит 12,04 • 1023 атомов S.
0,5 моль серы содержит 3,01 • 1023 атомов S.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню) или n (эн). Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
12,04 • 1023 молекул / 6,02 • 1023 молекул = 2 моль
В общем виде: 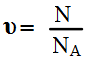
где N – число частиц данного вещества;
NА – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, относительная молекулярная масса метана CH4 определяется следующим образом: Мr(CH4) = Ar(C) + 4Ar(H) = 12+4 =16.
Аналогично можно рассчитать молярную массу метана: M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) υ, по формуле: 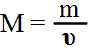
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей: 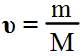
или найти массу вещества по числу молей и молярной массе: m = υ ▪ M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве υ = 2 моль каждого.
Решение:
Молярная масса метана M(CH4) = 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда: m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Рис.1 Массы 1 моль различных веществ
Вычисление υ используется практически в каждой расчетной задаче.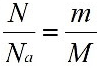
Взаимосвязь:
Образцы решения задач
Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль.
![]() Дано: Решение:
Дано: Решение:
ν(Fe)=0,5 моль m = M · ν
![]() M(Fe) = Ar(Fe) = 56 г/моль (из Периодической системы)
M(Fe) = Ar(Fe) = 56 г/моль (из Периодической системы)
Найти: m(Fe) - ? m (Fe) = 56 г/моль · 0,5 моль = 28 г
Ответ: m (Fe) =28 г
Задача №2. Вычислите массу (г) 12,04 · 1023 молекул оксида кальция CaО.
 Дано: Решение:
Дано: Решение:
N(CaO)= 12,04 * 1023 молекул m = M · υ, υ= N/NА,
![]() следовательно, формула для расчёта m = M · (N/NА)
следовательно, формула для расчёта m = M · (N/NА)
Найти: m(СaO) - ? M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль
m= 56 г/моль · (12,04 * 1023/6,02 · 1023 1/моль) = 112 г
Ответ: m= 112 г
Молярный объем газов. Закон Авогадро.
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро).
Cледствие из закона Авогадро: Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём. равный 22,4 л. Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.). Vm = 22,4 л/моль
н.у. – это p = 1атм (101325 Па); t = 0 ˚C (2730 К)
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества: υ = V / Vm = N / Na = m / M; M = ρ▪Vm
Образцы решения задач
Задача №1. Какой объем занимает 0,2 моль N2 при н.у.?
![]() Дано: н.у. Решение:
Дано: н.у. Решение:
Vm = 22, 4 л/моль ν (N2) = V(N2 ) / Vm , следовательно
ν (N2) = 0,2 моль V (N2 ) = ν (N2) · Vm = 0,2 моль · 22,4 л / моль = 4,48 л
![]() Ответ: V (N2 ) = 4,48 л
Ответ: V (N2 ) = 4,48 л
Найти:
V - ?
Задача №2. Какое количество вещества содержит водород объемом 33,6 л при н.у.?
![]() Дано: н.у. Решение:
Дано: н.у. Решение:
Vm = 22, 4 л/моль ν (Н2) = V(N2 ) / Vm = 33,6 л / 22,4 л/моль = 1,5 моль
V (H2) = 33,6 л Ответ: ν (Н2) = 1,5 моль
![]()
Найти:
υ(Н2)- ?
Задача №3. Какой объем займут 56 г газа СО при н.у.?
Дано: н.у. Решение:
![]() Vm = 22, 4 л/моль υ (CO) = V(CO) / Vm , следовательно V(CO ) = υ (CO) · Vm
Vm = 22, 4 л/моль υ (CO) = V(CO) / Vm , следовательно V(CO ) = υ (CO) · Vm
m (CO) = 56 г Неизвестное количество вещества найдём по формуле: υ = m/M
![]() M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
Найти: υ (СО) = m/M = 56 г / 28 г/моль = 2 моль
V(CO) -? V (CO ) = υ(CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Ответ: V (CO ) = 44,8 л
Оборудование: Периодическая система химических элементов Д.И.Менделеева, калькулятор.
Решите предложенные задачи, оформите их в соответствии с приведенными выше образцами.
Задание 1.
| Вариант 1 | Вариант 2 |
| Задача 1. Вычислите массу воды Н2О (г), взятой количеством вещества 5 моль. | Задача 1. Вычислите массу (г) 3 моль сероводорода Н2S. |
| Задача 2. Вычислите массу (г) 24,08 *1023 молекул серной кислоты H2SO4 | Задача 2. Вычислите массу (г) 18,06*1023 молекул азотной кислоты HNO3 |
| Задача 3. Какой объем занимают 5 моль О2 при н.у.? | Задача 3. Какой объем занимают 2,5 моль Н2 при н.у.? |
| Задача 4. Какое количество вещества содержит кислород О2 объемом 0,224 л при н.у.? | Задача 4. Какое количество вещества содержит углекислый газ СО2 объемом 4,48 л при н.у.? |
На дополнительную оценку:
Вариант 1. Какой объем займут 8 г газа О2 при н.у.?
Вариант 2. Какой объем займут 64 г газа SО2 при н.у.?
Контрольные вопросы для самопроверки.
| 1 вариант | 2 вариант |
| 1. Как называется количество вещества, в котором содержится 6∙1023 молекул этого вещества а) молярная масса б) моль в) постоянная Авогадро 2. Выберите значение постоянной Авогадро а) 22,4 б) 1 в) 6∙1023 3.В каких единицах измеряется молярный объем газов: а) л/моль б) моль в) литр 4. Запишите формулу для расчета количества вещества, если известно число молекул | 1. Что называют молярной массой вещества? а) это масса 1 молекулы вещества б) это масса 1 моль вещества в) это масса 3,01∙1023 молекул вещества. 2. Как называется объем газа количеством вещества 1 моль? а) молярная масса б) молярный объем в) постоянная Авогадро 3. В каких единицах измеряется количество вещества: а) л/моль б) моль в) литр 4. Запишите формулу для расчета количества вещества, ели известен его объем. |
Требования к содержанию и оформлению отчёта по практической работе
Запишите в журнал лабораторно-практических занятий:
Наименование работы
Цель работы
Ход работы:
Решения задач оформить в соответствии с образцом.
Привести ответы на задания контрольных вопросов.
Список литературы и интернет - источников
Учебник О.С. Габриелян, И.Г.Остроумов Химия для профессий и специальностей технического профиля, 2016, с. 12 - 17








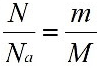
 Дано: Решение:
Дано: Решение:



















