
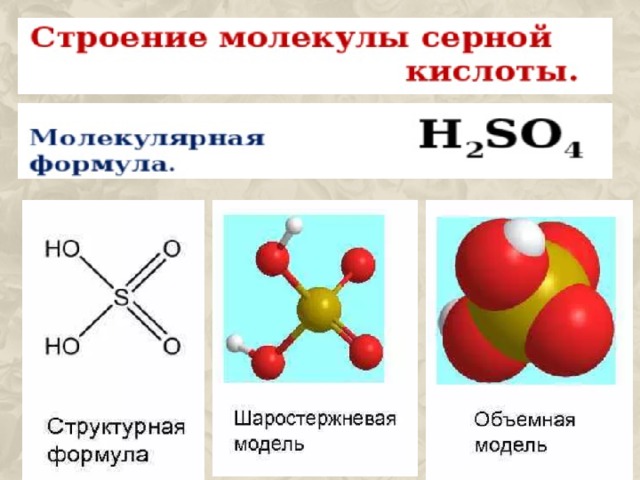

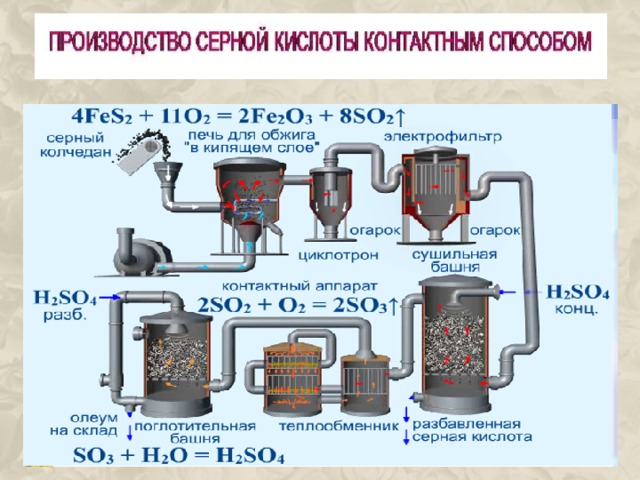




I . H 2 SO 4 ↔ H + + HSO 4 -
II . HSO 4 - ↔ H + + SO 4 2 -

3 . Взаимодействие с металлами
Mg + H 2 SO 4 →
Mg + H 2 SO 4 → Mg SO 4 + H 2 ↑
Al + H 2 SO 4 → Al 2 ( SO 4 ) 3 + H 2 ↑
Al + H 2 SO 4 →
3
2
3
Cu + H 2 SO 4 →


4 . Взаимодействие с ОКСИДАМИ.
(основными и амфотерными оксидами)
CaO + H 2 SO 4 →
CaO + H 2 SO 4 → Ca SO 4 + H 2 O
Al 2 O 3 + H 2 SO 4 →
Al 2 O 3 + H 2 SO 4 → Al 2 (SO 4 ) 3 + H 2 O
3
3

5 . Взаимодействие с гидроксидами
2
2
NaOH + H 2 SO 4 → Na 2 SO 4 + H 2 O
NaOH + H 2 SO 4 →
NaOH + H 2 SO 4 ( избыт) → NaHSO 4 + H 2 O
2
Cu (OH) 2 + H 2 SO 4 → CuSO 4 + H 2 O
Cu (OH) 2 + H 2 SO 4 →
3
Al (OH) 3 + H 2 SO 4 →
Al (OH) 3 + H 2 SO 4 → Al 2 (SO 4 ) 3 + H 2 O
6
2

6 . Взаимодействие с солями
CaC O 3 + H 2 SO 4 → CaSO 4 + H 2 O + CO 2 ↑
CaC O 3 + H 2 SO 4 →
Pb(NO 3 ) 2 + H 2 SO 4 →
Pb(NO 3 ) 2 + H 2 SO 4 → PbSO 4 ↓ + HNO 3
2

Серная кислота ( H 2 SO 4 )является двухоснОвной кислотой, соответствуют два типа солей: средние – сульфаты и кислые – гидросульфаты .
средние – сульфаты ( K 2 SO 4 , CaSO 4 );
кислые – гидросульфаты ( KHSO 4 , Ca ( HSO 4 ) 2










Качественной реакцией на серную кислоту
и её растворимые соли является их взаимодействие
с растворимыми солями бария , при котором образуется белый осадок сульфата бария , нерастворимый в воде и кислотах

























































