Просмотр содержимого документа
«Сильные и слабые электролиты»

Сильные и слабые электролиты. Степень и константа диссоциации

Степень электролитической диссоциации
Это отношение числа молекул, распавшихся в растворе на ионы, к общему числу исходных молекул, введенных в раствор (или расплав).

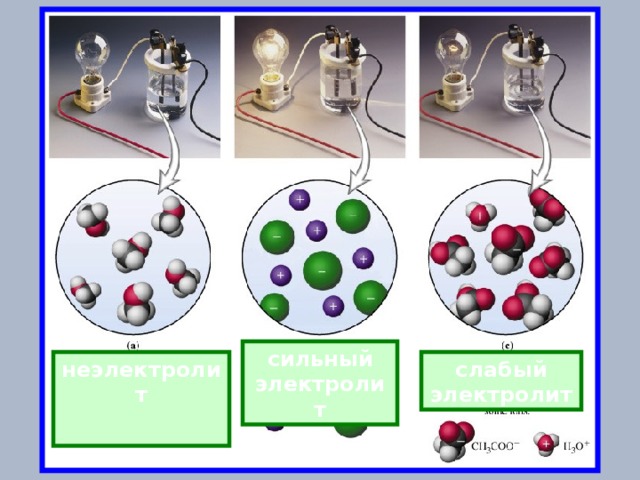
сильный электролит
неэлектролит
слабый электролит

Сильные электролиты
- кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);
- основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH, NaOH, KOH, RbOH, CsOH, а также гидроксиды щелочноземельных металлов – Ba(OH)2 , Ca(OH)2, Sr(OH)2
- соли, растворимые в воде


Слабые электролиты
- неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS, HСlO и др.);
- вода (H2O);
- гидроксид аммония (NH4OH);
- большинство органических кислот
- (например, уксусная CH3COOH, муравьиная HCOOH);
- нерастворимые и малорастворимые соли и гидроксиды некоторых металлов


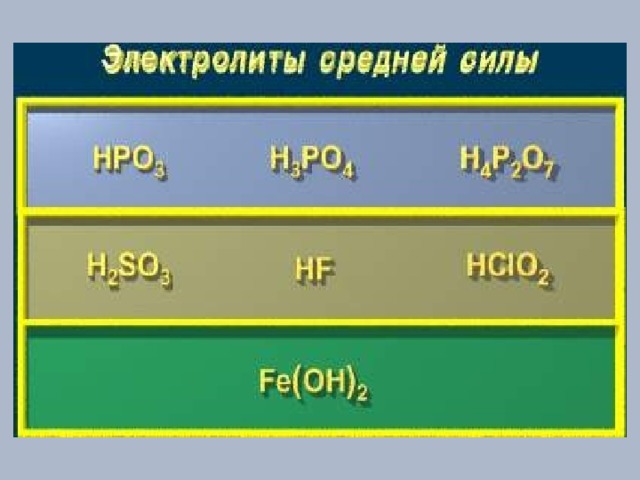
Константа диссоциации
Характеризует способность слабого электролита распадаться на ионы
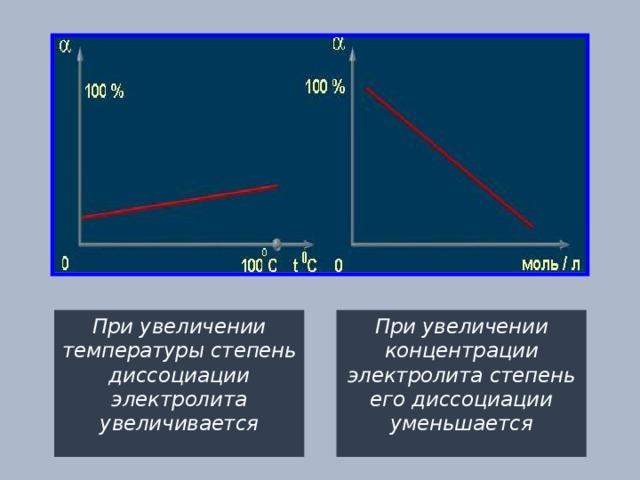
При увеличении температуры степень диссоциации электролита увеличивается
При увеличении концентрации электролита степень его диссоциации уменьшается
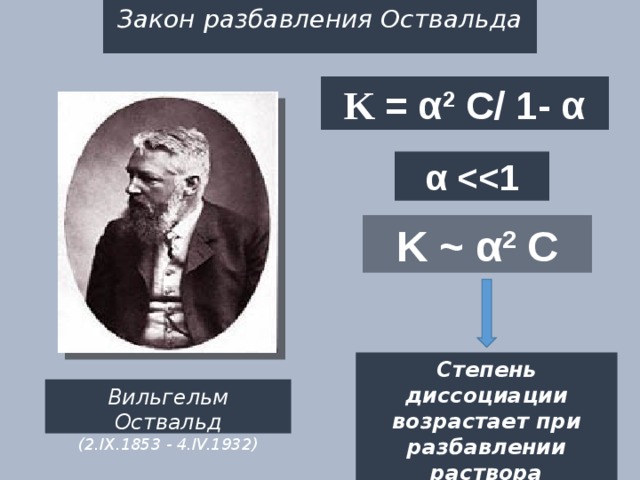
Закон разбавления Оствальда
K = α 2 C/ 1- α
α 1
K ~ α 2 C
Степень диссоциации возрастает при разбавлении раствора
Вильгельм Оствальд (2.IX.1853 - 4.IV.1932)
![Водородный показатель (рН) раствора Вода – очень слабый электролит. Из каждого миллиарда молекул воды только две распадаются на ионы: Н2О ↔ Н + ОН Произведение концентраций ионов водорода и гидрокисд-ионов в воде называют ионным произведением воды (Кв). При температуре 22˚С Кв – величина постоянная, численно равна 10ˉ¹⁴ Кв = [Н]*[ОН]= 10ˉ¹⁴](https://fsd.multiurok.ru/html/2019/01/10/s_5c3735a462ffa/img12.jpg)
Водородный показатель (рН) раствора
Вода – очень слабый электролит. Из каждого миллиарда молекул воды только две распадаются на ионы:
Н2О ↔ Н + ОН
Произведение концентраций ионов водорода и гидрокисд-ионов в воде называют ионным произведением воды (Кв). При температуре 22˚С Кв – величина постоянная, численно равна 10ˉ¹⁴
Кв = [Н]*[ОН]= 10ˉ¹⁴

Водородный показатель (рН) раствора
Водородный показатель рН – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
Существуют различные способы определения рН раствора. Для более точного определения рН служат электронные приборы, которые называют иономерами или рН-метрами. А примерную оценку кислотности водных растворов электролитов модно провести с помощью особых веществ – индикаторов (лакмуса, фенолфталеина, метилового оранжевого, универсального индикатора).

Проверь себя
Впишите недостающие слова:
- Все вещества по их способности проводить электрический ток в растворах делятся на ______________ и ________________ .
Процесс распада электролита на ионы называется __________________ ______________.
В растворах электролиты диссоциируют на _______________ и ______________ ионы.
2) Все соли – электролиты, CuSO4 – ___________ .
Все растворимые основания – сильные электролиты,
NaOH – ___________________ .
электролиты
неэлектролиты
электролитической диссоциацией
положительные
отрицательные
электролит
сильный электролит

Проверь себя
Покажите выигрышный путь, состоящий из названий веществ или растворов, которые:
а) проводят электрический ток
Хлорид натрия
Раствор сахара
(р-р)
Вода, насыщенная O 2
Сульфат натрия
Серная кислота
Дисциллированная вода
(р-р)
(р-р)
Азотная кислота
Спирт
(р-р)
Гидроксид натрия
(р-р)
б) не проводят электрический ток
Дисциллированная вода
Минеральная вода
Сахар (тв.)
Известковая вода
Соляная кислота
Раствор сахара
Нитрат натрия (р-р)
Гидроксид калия
Карбонат кальция (тв.)
(р-р)

Проверь себя
в) являются сильными электролитами
Раствор аммиака в воде
Сахар (тв.)
Гидроксид калия
Серная кислота
(р-р)
Соляная кислота
Угольная кислота
(р-р)
Дисциллированная вода
Нитрат натрия (р-р)
Карбонат кальция (тв.)

Проверь себя
Соотнесите:
1. А) Электролиты 1) Кислоты
Б) Неэлектролиты 2) Оксиды
3) Простые вещества
4) Соли
5) Основания
2. А) Сильные электролиты 1) Азотная кислот
Б) Слабые электролиты 2) Вода
3) Гидроксид натрия
4) Соляная кислота
5) Гидроксид алюминия
3. Электролиты: Ионы в растворе электролита:
А) NaCl
Б) KOH
В) HNO 3
+
1) OH¯ 4) K
+
2) H 5) NO 3 ¯
–
+
3) Na 6)Cl



















![Водородный показатель (рН) раствора Вода – очень слабый электролит. Из каждого миллиарда молекул воды только две распадаются на ионы: Н2О ↔ Н + ОН Произведение концентраций ионов водорода и гидрокисд-ионов в воде называют ионным произведением воды (Кв). При температуре 22˚С Кв – величина постоянная, численно равна 10ˉ¹⁴ Кв = [Н]*[ОН]= 10ˉ¹⁴](https://fsd.multiurok.ru/html/2019/01/10/s_5c3735a462ffa/img12.jpg)















