
Урок изучения нового материала


А)
Б)
.
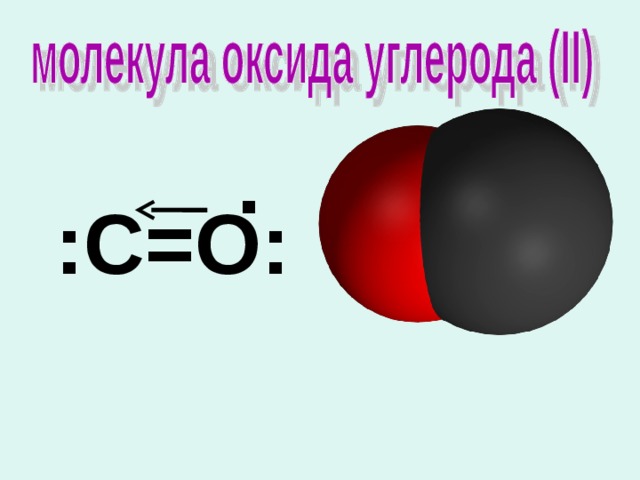
:С=О:

1. Формула:
C О
2. Валентность, степень
окисления:
II , + 2
3. Физические свойства:
Газ, бесцветный, без запаха, немного легче воздуха, плохо растворим в воде.
Т кип. = -191,5 град. Сильный яд!
4. Получение:
5. Химические свойства:
HCOOH → H 2 O + CO↑
муравьиная кислота
2CO + O 2 → 2 CO 2 + 577 кДж
CO + CuO → Cu + CO 2
При обычных условиях – инертен! Не реагирует с водой, кислотами, щелочами, несолеобразующий оксид. Сильный восстановитель.
6. Применение:
Для получения металлов из их оксидов, источник энергии (теплоты), в реакциях органического синтеза.

Проявления острой кислородной недостаточности могут начаться уже при концентрации СО в воздухе в 0,07%.



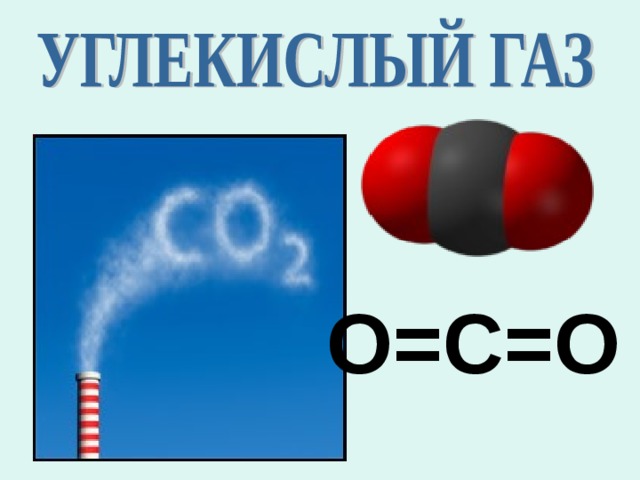
О=С=О

1. Формула:
СО 2
2. Валентность, степень
окисления:
IV , + 4
2. Физические свойства:
Газ, бесцветный, без запаха, тяжелее воздуха в 1,5 раза, мало растворим в воде, не поддерживает горение и дыхание.
3. Промышленное получение: в лаборатории
1) CaCO 3 → CaO + CO 2
2)CaCO 3 + 2HCl → CaCl 2 + H 2 CO 3 ( CO 2 + H 2 O )
4 . Химические свойства:
Кислотный оксид, реагирует с основными оксидами, с водой, с основаниями.
CO 2 + CaO → CaCO 3
CO 2 + H 2 O → H 2 CO 3
CO 2 + Ca(OH) 2 → CaCO 3 + H 2 O
5. Применение:
Производство соды, сахара, газирование напитков, в огнетушителях (в жидком виде), для хранения продуктов, для получения искусственного льда (в твёрдом виде)
Взаимодействие с металлами
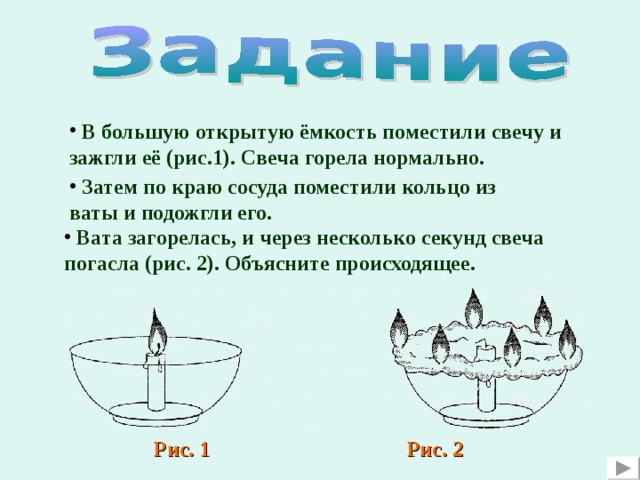
- В большую открытую ёмкость поместили свечу и зажгли её (рис.1). Свеча горела нормально.
- Затем по краю сосуда поместили кольцо из ваты и подожгли его.
- Вата загорелась, и через несколько секунд свеча погасла (рис. 2). Объясните происходящее.
Рис. 1
Рис. 2

Играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки.

Твёрдый диоксид углерода называют сухим льдом
Применяется для получения низких температур,
охлаждения продуктов

СО 2 СО .

Свойства оксидов
СО 2
SiO 2
Кислотный оксид
Кислотный оксид
Молекулярная
кристаллическая решетка
Атомная
кристаллическая решетка
Бесцветный газ.
Кристаллическое, твердое вещество, тугоплавкое.
Химические
свойства
H 2 O + CO 2 = H 2 CO 3
Не взаимодействует
CO 2 + CaO = CaCO 3
SiO 2 + CaO = CaSiO 3
CO 2 + Ca(OH) 2 =CaCO 3 + H 2 O
SiO 2 + NaOH = Na 2 SiO 3 + H 2 O
CO 2 + 2Mg = 2MgO + C
SiO 2 + 2C = 2MgO + Si
C + CO 2 = 2CO
SiO 2 + 2C = Si + 2CO


- В Мировом океане с 2002 года в 10 раз увеличилась концентрация Н 2 СО 3, которая образуется в результате растворения атмосферного СО 2 в соленой морской воде.

- слабая, двухосновная кислота, образующая два ряда солей : карбонаты и гидрокарбонаты.
- - слабая, двухосновная кислота, образующая два ряда солей : карбонаты и гидрокарбонаты.
- - слабая, двухосновная кислота, образующая два ряда солей : карбонаты и гидрокарбонаты.
- - слабая, двухосновная кислота, образующая два ряда солей : карбонаты и гидрокарбонаты.
- - слабая, двухосновная кислота, образующая два ряда солей : карбонаты и гидрокарбонаты.
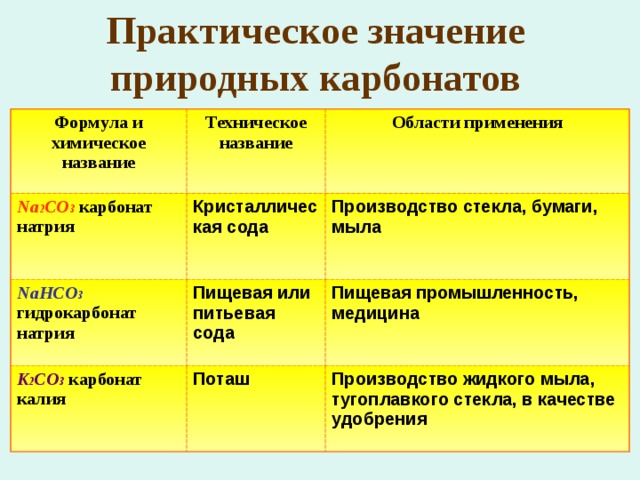
Практическое значение природных карбонатов
Формула и химическое название
Техническое название
Na 2 CO 3 карбонат натрия
Области применения
Кристаллическая сода
NaHCO 3 гидрокарбонат натрия
Пищевая или питьевая сода
Производство стекла, бумаги, мыла
K 2 CO 3 карбонат калия
Пищевая промышленность, медицина
Поташ
Производство жидкого мыла, тугоплавкого стекла, в качестве удобрения
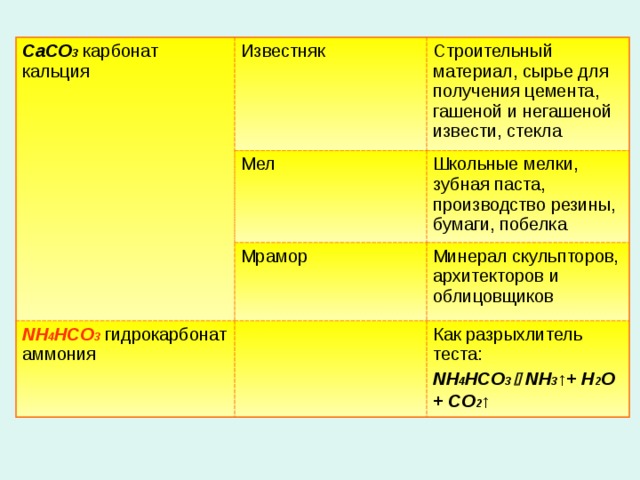
CaCO 3 карбонат кальция
Известняк
Строительный материал, сырье для получения цемента, гашеной и негашеной извести, стекла
Мел
Школьные мелки, зубная паста, производство резины, бумаги, побелка
Мрамор
NH 4 HCO 3 гидрокарбонат аммония
Минерал скульпторов, архитекторов и облицовщиков
Как разрыхлитель теста:
NH 4 HCO 3 NH 3 ↑+ H 2 O + CO 2 ↑

Карбонаты
натрия и аммония
Поташ
К2СО3



арагонит
жемчуг
Природные
карбонаты
к
доломит
кальцит




Ответы:
1 вариант :
1-1, 2- 3, 3- 1, 4- 3, 5-2 и 3, 6-2.
2 вариант:
1-4, 2-3, 3-4, 4-4, 5-1 и 2, 6-3.























































