Химия 8 класс. Конспект объясняющего модуля
Тема: Соли состав, классификация, номенклатура, способы получения
1)Цели урока:
Образовательные: создать условия для усвоения учащимися понятия о солях, их составе, номенклатуре, выработать умения отличать соли от представителей других классов неорганических соединений, классифицировать соли по составу и растворимости в воде, познакомить с физическими свойствами солей.
Развивающие: способствовать развитию практических умений при работе с химическим оборудованием и реактивами, развивать способность наблюдать и делать выводы.
Воспитательные: развитие химической речи, продолжить формирование умения высказывать свои взгляды и суждения.
2)Тип урока: урок формирования новых знаний
Ход урока.
-
Организационный момент. Мотивация к учебной деятельности учащихся.
-
Актуализация опорных знаний обучающихся.
-
Изучение нового материала.
Сегодня речь пойдет о самом представительном классе неорганических веществ. Они растворены в морской воде, окружают нас в повседневной жизни, в быту именем этого класса мы называет только одно вещество. Это соли.
Соли образуются в результате нейтрализации кислоты основанием:
NaOH + HCl = NaCl + H2O
Поэтому соли состоят из атомов металлов, которые связаны с кислотными остатками. Таким образом, можно сформулировать определение: соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
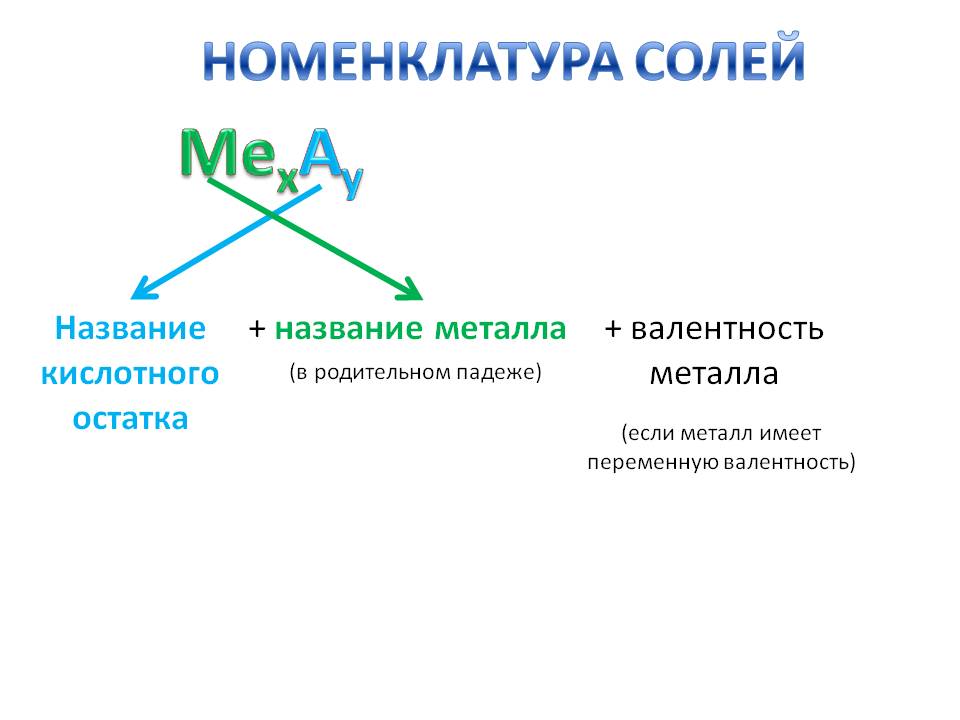
Многие соли имеют свои исторически сложившиеся названия. Но на химическом языке названия солей образуются так: сначала называем кислотный остаток (например, хлорид), добавляем название металла в родительном падеже (например, натрия) – NaCl, CaSO4 – сульфат кальция; CuSO4 – сульфат меди (II).
Если при образовании соли все атомы водорода в молекуле кислоты замещаются атомами металла, то про такую соль говорят «средняя» – Na2SO4. Но иногда атомы металла лишь частично замещают атомы водорода в кислоте, тогда мы говорим, что это кислая соль – NaHSO4. Также существуют и основные соли – Al(OH)2Cl.
Поэтому по составу соли можно разделить на группы:
-
Закрепление изученного материала.
Существуют различные способы получения солей.
-
Взаимодействие кислот.
- с металлами: 2H3PO4 + 6Na = 2Na3PO4 + 3H2↑
- с основными оксидами: 3H2SO4 + Fe2O3 =(t) Fe2(SO4)3 + 3H2O
- с основаниями: 3HNO3 + Cr(OH)3 = Cr(NO3)3 + 3H2O
-
Взаимодействие кислотных оксидов.
- с щелочами: N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
- с основными оксидами: SiO2 + CaO =(t) CaSiO3
3. Взаимодействие солей.
- с кислотами: Ca3(PO4)2 + 3H2SO4 =(t) 3CaSO4 + 2H3PO4
- с щелочами: Fe(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
- с металлами: CuSO4 + Fe =(t) FeSO4 + Cu↓
- с нелетучими кислотными оксидами: CaCO3 + SiO2 =(t) CaSiO3 + CO2↑
- с другими солями: Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
4. Взаимодействие металлов с неметаллами: 2Fe + 3Cl2 → 2FeCl3 (горение)
Справочные материалы
-
Подведение итогов урока.
-
Рефлексия.
-
Домашнее задание________________________________________
2




























