
Fe(OH) 2
Cu(OH) 2
Основания: номенклатура, классификация, применение, физические свойства
Cr(OH) 3
Fe(OH) 3

(О -2 Н +1 ) -
Основания – Me +n (OH) - n
- Это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов ОН -
- Названия оснований – «гидроксид + название металла в родительном падеже + (римская цифра с.о. Ме)»
- Например: NaOH – гидроксид натрия
Fe(OH) 2 – гидроксид железа ( II )
Fe(OH) 3 – гидроксид железа ( III )
+1
+2
+3
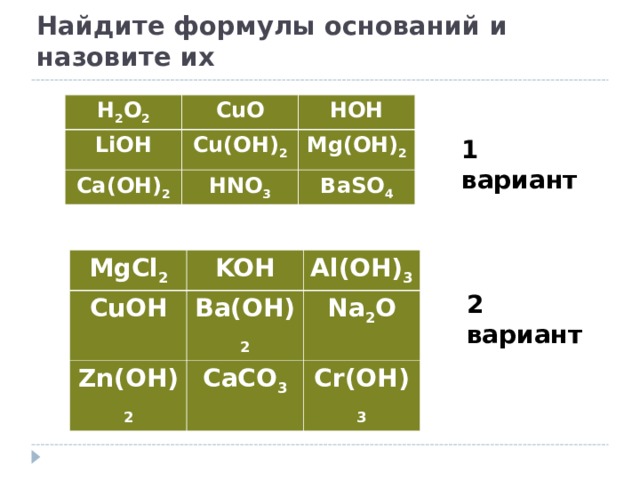
Найдите формулы оснований и назовите их
H 2 O 2
CuO
LiOH
HOH
Cu(OH) 2
Ca(OH) 2
Mg(OH) 2
HNO 3
BaSO 4
1 вариант
MgCl 2
CuOH
KOH
Al(OH) 3
Ba(OH) 2
Zn(OH) 2
Na 2 O
CaCO 3
Cr(OH) 3
2 вариант
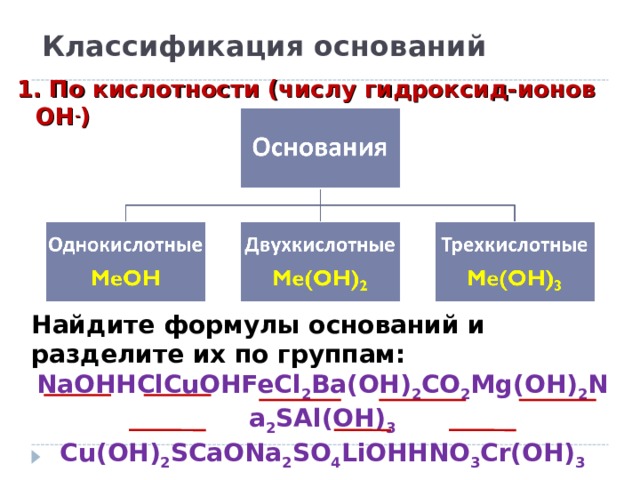
Классификация оснований
1. По кислотности (числу гидроксид-ионов ОН - )
Найдите формулы оснований и разделите их по группам:
NaOHHClCuOHFeCl 2 Ba(OH) 2 CO 2 Mg(OH) 2 Na 2 SAl(OH) 3
Cu(OH) 2 SCaONa 2 SO 4 LiOHHNO 3 Cr(OH) 3
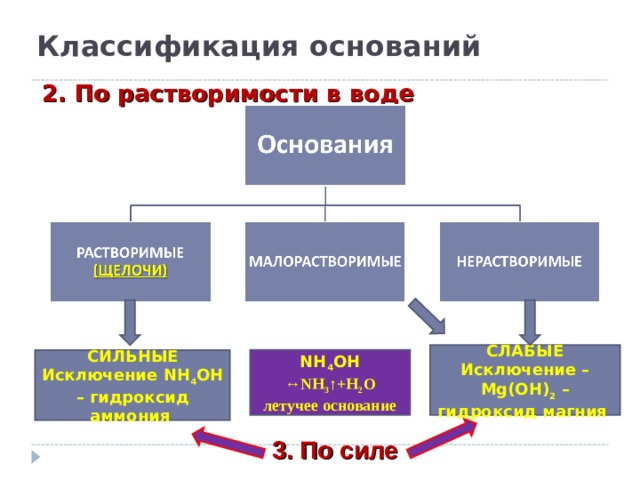
Классификация оснований
2. По растворимости в воде
СЛАБЫЕ
Исключение – Mg(OH) 2 – гидроксид магния
СИЛЬНЫЕ
Исключение NH 4 OH – гидроксид аммония
NH 4 OH ↔NH 3 ↑+H 2 O
летучее основание
3. По силе
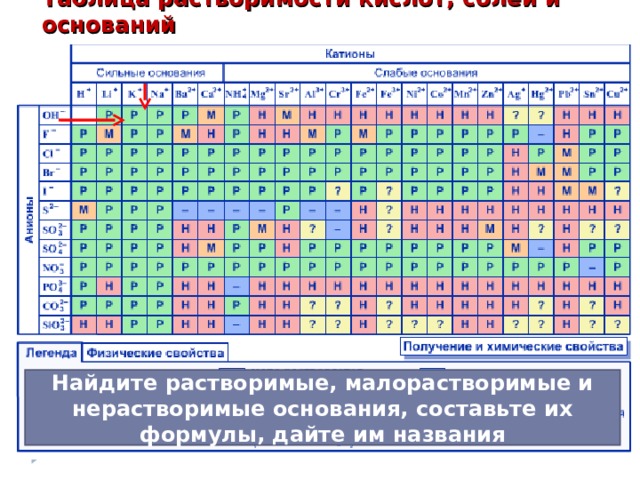
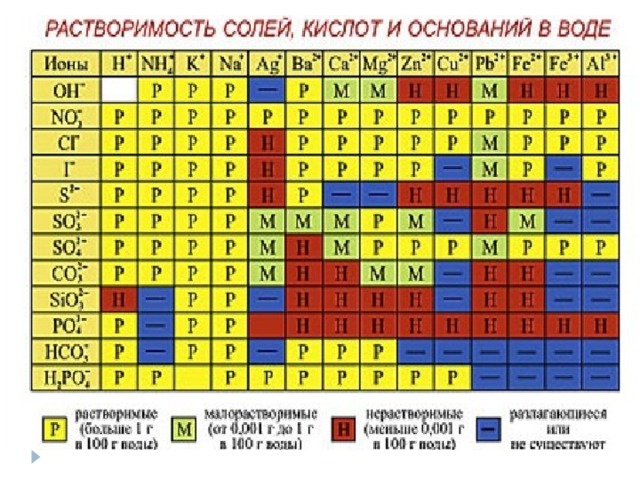
Таблица растворимости кислот, солей и оснований
Найдите растворимые, малорастворимые и нерастворимые основания, составьте их формулы, дайте им названия

Рассмотрите образцы оснований:
Гидроксид
железа ( III)
Гидроксид
кальция
Гидроксид
натрия
Гидроксид
меди ( II)
Гидроксид алюминия

Качественные реакции
- Реакции, с помощью которых распознают определенные вещества
- Как можно определить основания?
- Щелочи – определяют с помощью индикаторов
- Индикаторы (от лат. «указатели»)- вещества, изменяющие свою окраску в зависимости от среды раствора
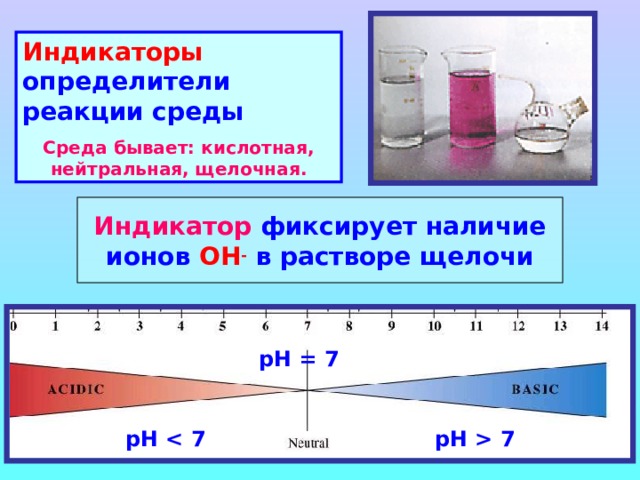 7 " width="640"
7 " width="640"
Индикаторы определители реакции среды
Среда бывает: кислотная, нейтральная, щелочная.
Индикатор фиксирует наличие ионов ОН - в растворе щелочи
рН = 7
рН
рН 7
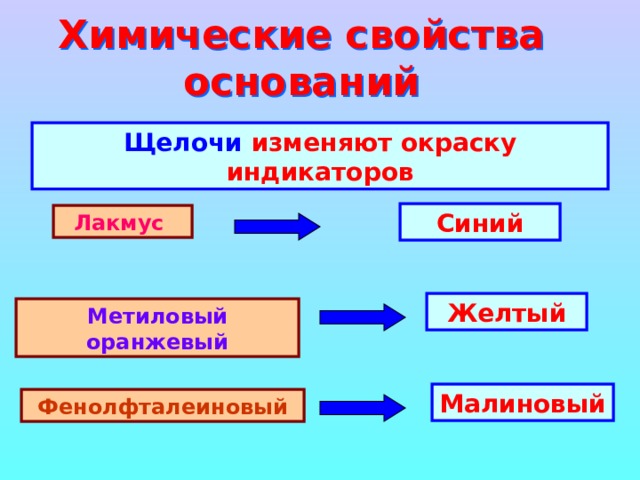
Химические свойства оснований
Щелочи изменяют окраску индикаторов
Синий
Лакмус
Желтый
Метиловый оранжевый
Малиновый
Фенолфталеиновый
 7 Нейтральная среда рН =7 " width="640"
7 Нейтральная среда рН =7 " width="640"
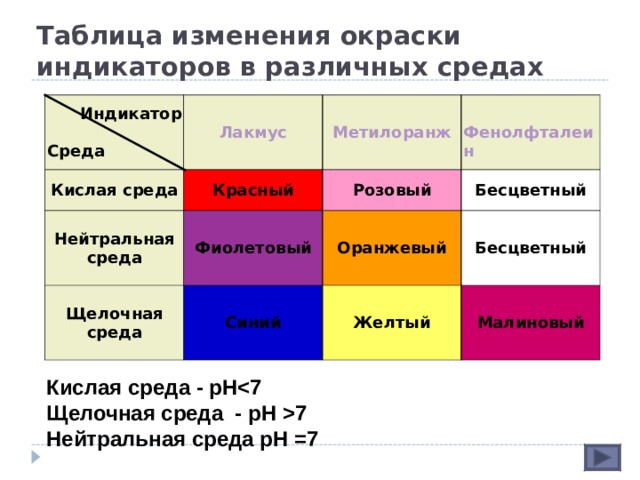
Таблица изменения окраски индикаторов в различных средах
Индикатор
Среда
Лакмус
Кислая среда
Нейтральная среда
Метилоранж
Красный
Щелочная среда
Фиолетовый
Розовый
Фенолфталеин
Бесцветный
Оранжевый
Синий
Бесцветный
Желтый
Малиновый
Кислая среда - рН
Щелочная среда - рН 7
Нейтральная среда рН =7

Лакмус
- Красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов
- В кислых средах (pH8,3) — синюю
- Добывается из растительного сырья, в частности из некоторых лишайников
- Впервые был применён в качестве химического реагента и индикатора других веществ около 1300г. испанским врачом и алхимиком Арнальдусом де Виланова (Arnaldus de Villanova)
- С XVI-ого века, когда информация о способе получения лакмуса распространилась, голубой лакмус из лишайников в промышленных количествах начал производиться в Голландии на экспорт под названиями "Bergmoos" и "Klippmoos". В 1704 году этот индикатор получил своё нынешнее название — лакмус

Метиловый оранжевый
- является органическим синтетическим красителем из группы азокрасителей
- в кислой среде красный, в щелочной — жёлтый
- Метиловый оранжевый получают, диазотируя сульфаниловую кислоту, а затем сочетая полученное вещество с диметиланилином

Фенолфталеин
- Трифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску от бесцветной (при pH
- Вещество представляет собой бесцветные кристаллы, плохо растворимые в воде, но хорошо — в спирте и диэтиловом эфире.
- Пурген (фенолфталеин) применяют как слабительное средство.

Качественное определение веществ
- Известковая вода – качественный реагент на углекислый газ
- Гидрокси́д ка́льция ( Ca(OH) 2 ,
гашёная известь или «пушонка») — химическое вещество, сильное основание. Представляет собой порошок белого цвета, плохо растворимый в воде
С a(OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
помутнение известковой воды
CaCO 3 + CO 2 + H 2 O → Ca(HCO 3 ) 2
растворение осадка

Известковая вода
- Прозрачный раствор гидроксида кальция . Она используется для обнаружения углекислого газа. При взаимодействии с ним она мутнеет, так как образуется нерастворимый карбонат кальция: Ca(OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O.
- Известковое молоко — взвесь (суспензия) гидроксида кальция в воде , белая и непрозрачная. Она используется для производства сахара и приготовления смесей для борьбы с болезнями растений, побелки стволов.

Гидроксид натрия
- другие названия — каустическая сода , каустик , едкий натр , едкая щёлочь — самая распространённая щёлочь, разъедает кожу, бумагу, и другие органические вещества, вызывая сильные ожоги, потерю зрения
- химическая формула NaOH .
- белое твердое вещество. Если оставить кусок едкого натра на воздухе , то он вскоре расплывается , так как притягивает влагу из воздуха. Едкий натр хорошо растворяется в воде , при этом выделяется большое количество теплоты . Раствор едкого натра мылок на ощупь .
- В год в мире производится и потребляется более 57 миллионов тонн едкого натра.

Историческая справка о NaOH
- До XVII века щёлочью (фр. alkali ) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем.
- В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.

Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
- в целлюлозно-бумажной промышленности для делигнификации целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит
- Для омыления жиров при производстве мыла, шампуня и других моющих средств
- В химических отраслях промышленности
- Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9 :1), а также щелочной катализатор (NaOH) – хорошая воспламеняемость и высокое цетановое число
- В гражданской обороне для дегазации и
нейтрализации отравляющих веществ
Использование NaOH
- Гидроксид натрия также используется в сочетании с цинком для фокуса . Медную монету кипятят в растворе гидроксида натрия в присутствии гранул металлического цинка, через 45 секунд цвет копейки станет серебристым. После этого копейку вынимают из раствора и нагревают в пламени горелки, где она, практически моментально становится «золотой». Причины этих изменений заключается в следующем: ионы цинка вступают в реакцию с гидроксидом натрия (в недостатке) с образованием Zn (OH) 4 2− — который при нагревании разлагается до металлического цинка и осаждается на поверхность монеты. А при нагревании цинк и медь образуют золотистый сплав — латунь.
- для мойки пресс-форм автопокрышек.
- для нелегального производства метамфетаминов и других наркотических средств.
- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E524 . Некоторые блюда готовятся с применением каустика:
- Лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию. Брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
- Лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
- Брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
- В косметологии для удаления ороговевших участков кожи: бородавок, папиллом.

Гидроксид калия
- «калиевый щёлок» — KOH.
- Тривиальные названия: едкое кали, каустический поташ .
- Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия.
- Водные растворы КОН имеют сильнощелочную реакцию.
- Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.

Применение гидроксида калия
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E525 .
- для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
- в производстве жидких мыл, как исходный продукт для получения различных солей калия и т. д.
- В циркониевом производстве используется для получения обесфторенной гидроокиси циркония.
- В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, остатков механической обработки.
- в качестве электролита в щелочных (алкалиновых) батарейках.
- в ресомации - альтернативном способе "захоронения" тел.

Техника безопасности при работе с NaOH и KOH
- При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струей воды , а при попадании на кожу слабым раствором уксусной кислоты .
- При работе с едким натрием рекомендуется использовать следующие защитные средства : химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела — химически-стойкая одежда пропитанная винилом или прорезиненные костюмы.
- ПДК гидроксида натрия в воздухе 0,5 мг/м³.

Составить формулы оксидов, соответствующих гидроксидам
Гидроксид калия – К +1 ОН – оксид калия К +1 2 О
Гидроксид натрия - … - …
Гидроксид железа ( III )- … - …
Гидроксид меди ( II ) - … - …
Гидроксид меди ( I ) - … - …
Гидроксид алюминия - … - …

Тест «Пятерочка»
- 1 . Выберите формулы оснований:
- а) SO 3 б) Mg(OH) 2 в) H 2 SO 4 г) СаО
- 2. К каждому из ниже указанных веществ прибавили фенолфталеин. С каким веществом появится малиновое окрашивание? а) BaO б) HNO 3 в) КОН
- 3. Гидроксид-ион (OH) ⁻ входит в состав:
- а) оксидов б) оснований в) углекислого газа
- 4. Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом:
- а) лакмус синеет б) Метилоранж краснеет
- в) фенолфталеин бесцветный
- 5. Выберите формулу щелочи
- а) КОН б) H 2 S в) С u (ОН) 2

РЕШИТЕ ЗАДАЧИ
- Вычислите количество вещества, которое составляют 342 г гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щелочи?
- Вычислите количество вещества, которое составляют 7,4 мг гидроксида кальция. Сколько ионов каждого вида будет содержать эта порция щелочи?














 7 " width="640"
7 " width="640"

 7 Нейтральная среда рН =7 " width="640"
7 Нейтральная среда рН =7 " width="640"


































