

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Техника приготовления растворов
Подготовка Лаборанта химического анализа
Просмотр содержимого документа
«Техника приготовления растворов»
Раствором называют однородную (гомогенную) смесь растворенного вещества, растворителя и продуктов их взаимодействия. Молекулы растворенного вещества в растворе равномерно распределены между молекулами растворителя.
Растворы могут быть водными и неводными. В аналитической химии чаще всего приходится иметь дело с водными растворами различных веществ. Водные растворы кислот, солей и щелочей способны проводить электрический ток, поэтому эти вещества называются электролитами. Водные растворы некоторых органических веществ, например сахара, спиртов, глицерина, не проводят электрический ток; такие вещества называются неэлектролитами.
Концентрацией растворов называют содержание (массу, объем, количество) растворенного вещества в единице массы (объема, количества) растворителя или раствора. Концентрацию растворов чаще всего выражают в процентах — массовых, объемных или мольных, в граммах в литре раствора или в 100 мл растворителя, а также в молях в литре (молярность) или в эквивалентах в литре (нормальность). Существуют и другие способы выражения концентрации растворов.
Растворы, в которых при данных условиях не может происходить дальнейшее растворение вещества, называются насыщенными. Концентрация, соответствующая насыщенному раствору, называется растворимостью данного вещества. Растворимость выражают в тех же единицах, что и концентрацию. Например, растворимость хлорида калия при 20°С составляет 34,0 г/100 мл H2O. Это означает, что в 100 мл воды при 20°С может раствориться не более 34,0 г KCl. Растворимость большинства веществ увеличивается с повышением температуры.
Растворы, концентрация которых выражена в процентах (по массе)
Концентрация раствора, выраженная в процентах, указывает на содержание растворенного вещества в 100 г раствора (но не в 100 мл раствора). Зная концентрацию, можно вычислить навеску растворяемого вещества, необходимую для приготовления нужного количества раствора.
При приготовлении растворов сухие вещества взвешивают на весах, а воду отмеривают мерным цилиндром (поскольку плотность воды равна единице). После проведения необходимых вычислений отвешенное вещество помещают в колбу или стакан и, прилив часть отмеренной воды, взбалтывают или размешивают стеклянной палочкой до полного растворения вещества, затем добавляют остальную воду и хорошо перемешивают. Для ускорения растворения вещество рекомендуется предварительно измельчать в фарфоровой ступке. Измельчение проводят до взвешивания, потому что часть вещества во время измельчения может потеряться.
Поскольку растворимость многих веществ увеличивается с повышением температуры, для ускорения процессов растворения иногда прибегают к подогреванию на газовой горелке или электроплитке (на асбестовой сетке), непрерывно размешивая, так как иначе осевшее на дно нерастворенное вещество вызовет местный перегрев и может произойти выброс смеси из сосуда или растрескивание сосуда. Если растворяемое вещество разлагается при нагревании, то повышение температуры при его растворении недопустимо.
Молярные растворы
Молярным называется раствор, содержащий в 1 л раствора 1 моль растворенного вещества. Молярность обозначается буквой М. Молярные растворы приготовляют в мерных колбах. Для приготовления 1 М раствора данного вещества вычисляют молекулярную массу (как сумму атомных масс входящих в него элементов) или находят ее по справочным таблицам. Берут точную навеску, равную в граммах молекулярной массе вещества. Взвешивание производят в чистом и сухом бюксе или на часовом стекле. Затем навеску небольшими порциями пересыпают через воронку с укороченной трубкой в чистую мерную колбу вместимостью 1 л. Чтобы вещество не забивало трубку воронки, до взвешивания его измельчают в ступке. Затем несколько раз тщательно промывают бюкс струей воды из промывалки, чтобы все содержимое бюкса попало в воронку, вставленную в горло колбы, после чего воронку также тщательно промывают.
Путем перемешивания полностью растворяют вещество, находящееся в колбе (объем воды и соли не должен превышать половины вместимости колбы), и доводят водой раствор в колбе до метки.
Последние капли воды добавляют из пипетки с резиновой грушей, прислонив ее кончик к стенке горла колбы и наблюдая за тем, чтобы нижний край мениска касался линии метки. Колба при этом должна стоять на столе, ее нельзя держать в руках, во избежание некоторого нагрева раствора. Глаз наблюдателя должен находиться на уровне метки, чтобы при наблюдении сбоку противоположные линии кольцевой метки сливались в одну черту. Наблюдение следует вести на фоне белого экрана (листа бумаги). После наполнения колбы водой до метки раствор хорошо перемешивают.
Нормальные растворы
Нормальным называется раствор, в 1 л которого содержится 1 моль эквивалентов растворенного вещества. Нормальность обозначается буквой «н.» (в тексте) или N (в формулах).
Эквивалент кислоты численно равен ее молекулярной массе, деленной на основность. Эквивалент основания равен его молекулярной массе, деленной на число гидроксильных групп. Эквивалент соли равен ее молекулярной массе, деленной на число атомов металла, входящего в состав соли, и на валентность этого металла. В окислительно-восстановительных реакциях эквивалент вещества находят делением молекулярной массы вещества на число отдаваемых или принимаемых электронов в данной реакции.
Нормальные растворы готовят так же, как молярные растворы, разница состоит лишь в том, что растворяемого вещества берут, например, не 1 моль, а 1 эквивалент.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
![]()
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
![]()
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
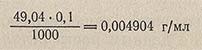
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
![]()
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Формулы перехода от одних выражений концентрации растворов к другим
Примем следующие условные обозначения концентрации:
С% — процентная концентрация по массе;
А — число единиц массы растворенного вещества на 100 единиц массы растворителя;
Б — масса растворенного вещества в 1 л раствора;
Сн — число эквивалентов растворенного вещества в 1 л раствора (нормальность);
См — число молей растворенного вещества в 1 л раствора (молярность);
m — число молей растворенного вещества на 1000 г растворителя (моляльность);
Э — эквивалентная масса растворенного вещества, г/моль;
М — мольная масса растворенного вещества, г/моль;
d — относительная плотность.
Тогда
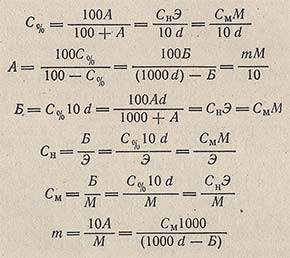
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
Техника приготовления растворов
По точности выражения концентрации растворы делят на приблизительные, точные и эмпирические.
Растворы кислот и оснований приблизительной концентрации служат в качестве вспомогательных реагентов при выполнении аналитических, препаративных и других работ. Концентрацию подобных растворов рассчитывают либо по степени разбавления исходных веществ (растворов), либо по массе вещества (взвешивается на технических весах), растворенного в известной массе растворителя. Часто приблизительную концентрацию растворов определяют по величине плотности.
Растворы с точной, заранее установленной концентрацией, называемые рабочими, стандартными или титрованными растворами, служат для определения точной концентрации других растворов.
Концентрации многих растворов вспомогательных веществ (индикаторы, специфические реактивы и др.) устанавливаются эмпирически и приводятся в соответствующих прописях.
Независимо от того, какие по точности концентрации приготовляют растворы, применять следует только чистые исходные вещества и воду высокой степени очистки, а в ряде случаев (для растворов NaOH, Na2S2O3) — очищенную от CO2.
Следует иметь в виду, что скорость растворения твердого вещества зависит от размера его частиц (тонкоизмельченное растворяется быстрее).
Некоторые вещества не смачиваются водой и плавают на ее поверхности, образуя тонкую пленку. Для приготовления водных растворов подобных веществ рекомендуют порошок вначале облить небольшим количеством этилового спирта (если он инертен по отношению к компонентам раствора), а уже затем приливать воду.
Сосуды для растворения и хранения растворов оснований должны быть снабжены хлоркальциевыми трубками, заполненными аскаритом или натронной известью, чтобы защитить раствор от СO2. В некоторых случаях растворы следует хранить в атмосфере инертного газа (N2, СO2). Растворы веществ, разлагающихся под действием света, например AgNO3, следует хранить в сосудах из коричневого стекла или покрытых черным лаком (в крайнем случае обернутых в черную бумагу).
Приготовление водных растворов кислот приблизительной концентрации
Водные растворы кислот (H2SO4, HCl, HNO3) обычно приготовляют соответствующим разбавлением исходных химически чистых концентрированных кислот. Разбавление проводят из расчета на объем, так как жидкость всегда легче отмерить, чем взвесить. Чтобы получить разбавленную кислоту (например, 1:5), к 5 объемам воды прибавляют 1 объем кислоты.
Процентное содержание концентрированных кислот контролируют по плотности, определяемой большей частью ареометром. Значения концентрации кислот в зависимости от плотности см. в справочниках.
Обращаться с концентрированными кислотами следует осторожно, так как они сильно действуют на кожу, разрушают одежду и обувь, портят полы и столы. При работе с концентрированными кислотами необходимо пользоваться резиновыми перчатками и защитными очками.
При приготовлении разбавленных растворов кислот (в особенности H2SO4) следует приливать кислоту в воду тонкой струей при непрерывном перемешивании стеклянной палочкой. Если при этом смесь сильно разогрелась, то ее охлаждают, после чего приливают следующую порцию кислоты.
Кислоту, попавшую на обувь или одежду, необходимо незамедлительно смыть большим объемом воды, нейтрализовать аммиаком или NaHCO3 и снова обмыть водой. Кислоту, разлитую на столе или на полу, засыпают песком, нейтрализуют Na2CO3, СаО, Са(ОН)2, СаСО3 и лишь после этого производят уборку.
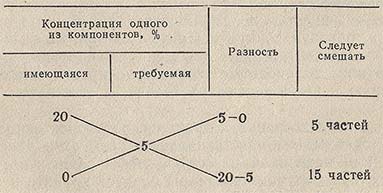
При приготовлении разбавленных растворов из более концентрированных или путем смешения растворов разных концентраций, для расчета соотношения объемов удобно пользоваться так называемым правилом креста или смешения. Это правило может быть иллюстрировано схемой получения 5% (по массе) раствора разбавлением 20% раствора:
Правило креста распространяется и на случай, когда концентрация смешиваемых водных растворов выражена через плотность. Пусть дан водный раствор плотностью 1,57 г/см3. Нужно из него приготовить раствор с плотностью 1,20 г/см3. По правилу креста составляем схему:
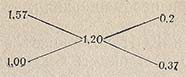
отсюда следует, что нужно смешать 20 см3 раствора с р = 1,57 г/см3 с 37 частями по массе воды.
Расчет концентрации по правилу креста не отличается точностью, и пользоваться этим методом можно лишь для приготовления растворов приблизительной концентрации.
Приготовление безводного раствора хлорной кислоты
Раствор хлорной кислоты в безводной уксусной кислоте широко применяют в качестве титранта для кислотно-основного титрования в неводной среде.
Промышленность выпускает хлорную кислоту различной концентрации (от 42 до 70%), чаще всего в виде 57% водного раствора с плотностью около 1,50.
Избыточную воду из хлорной кислоты удаляют уксусным ангидридом:
![]()
Предварительно определив содержание воды в хлорной кислоте, последнюю растворяют в ледяной уксусной кислоте и рассчитывают, какой объем V1 (в мл) уксусного ангидрида необходим для удаления из хлорной кислоты избыточной воды:
![]()
где 100 — А — содержание воды в исходном растворе НСlO4, %;
V — объем НСlO4, взятый для приготовления раствора, мл;
р — плотность применяемого раствора HClO4, г/см3;
p1 — плотность уксусного ангидрида, г/см3;
102 — молекулярная масса уксусного ангидрида;
18 — молекулярная масса воды.
Определенный объем HClO4 V постепенно, при непрерывном перемешивании, вливают в 800 мл ледяной уксусной кислоты, прибавляют V1 мл уксусного ангидрида, тщательно перемешивают, доводят объем раствора ледяной уксусной кислотой до 1 л и снова перемешивают. Через сутки раствор готов.
Приготовление растворов щелочей
При растворении NaOH или КОН необходимо пользоваться резиновыми перчатками и защитными очками. Щелочи вызывают химический ожог кожи, разрушают одежду и обувь. Брать твердую щелочь руками запрещается.
Водные растворы NaOH и КОН
При растворении твердых NaOH и КОН в воде происходит сильное разогревание; поэтому насыщенные растворы щелочей приготовляют в термостойкой стеклянной или, лучше, в фарфоровой посуде, постепенно добавляя твердую щелочь при перемешивании, чтобы избежать местного перегрева.
На воздухе NaOH и КОН поглощают воду и СO2. Образующиеся карбонаты мало растворимы в концентрированном растворе щелочей и постепенно выпадают в осадок.
Концентрированные растворы щелочей при хранении в стеклянной посуде разрушают стекло, выщелачивая из него кремневую кислоту. Поэтому лучше хранить их в сосудах из полиэтилена.
Из концентрированных растворов получают разбавленные растворы щелочей, концентрацию которых контролируют по плотности. Ориентировочное значение объемов разбавляемого раствора щелочи и воды можно рассчитать и по правилу креста.
Приготовление 50% раствора NaOH, не содержащего карбонатов (по ГОСТ 4517-2016), производят следующим образом: в фарфоровом стакане растворяют при постепенном добавлении и перемешивании 250 г NaOH в 250 мл дистиллированной воды. После охлаждения раствор переливают в полиэтиленовый сосуд, закрывают пробкой и выдерживают 2-3 недели, до полного осаждения NaCO3. Затем прозрачный раствор сифонируют стеклянной трубкой и соответственно разбавляют водой, не содержащей СO2.
Спиртовый раствор КОН
Растворимость NaOH и КОН в метиловом спирте выше, чем в этиловом. Однако поскольку метиловый спирт очень токсичен и огнеопасен, обычно используют этанольные растворы NaOH и КОН. Растворимость NaOH в этиловом спирте при 28°С составляет 14,7%, а КОН — 27,9%.
Для приготовления раствора КОН применяют этиловый ректификованный спирт, предварительно очищенный от альдегидов.
Наиболее эффективен следующий способ очистки: раствор из 2 г AgNO3 в 5 мл дистиллированной воды вливают в 1200 мл этилового спирта, находящегося в склянке с притертой пробкой, и тщательно перемешивают. Отдельно растворяют 5 г КОН в 25 мл горячего этилового спирта, раствор охлаждают и вливают в спиртовой раствор AgNO3. Выпадает осадок Ag2O, которому дают осесть, фильтруют и отгоняют спирт. Этиловый спирт, очищенный этим способом, остается бесцветным несколько лет.
Спиртовой раствор КОН при хранении часто приобретает слабо-желтую окраску, вызываемую осмолением примесей. Для приготовления растворов КОН, не окрашивающихся при длительном хранении, рекомендуют спирт предварительно обработать бутилатом алюминия (5 г на 1 л спирта). Смеси дают постоять 3-4 недели при комнатной температуре, после чего спирт декантируют и растворяют в нем КОН.
Приготовление водного раствора аммиака
Поступающий в продажу водный раствор аммиака плотностью 0,901-0,907 г/см3 при 20 °С, содержит 25-27% NH3. Препарат и его разбавленные растворы вполне пригодны для выполнения большинства препаративных и вспомогательных лабораторных работ.
Для аналитических работ ГОСТ 4517-2016 рекомендует приготовлять растворы из баллонного жидкого синтетического аммиака или из водного аммиака, поступающего в продажу.
Газообразный аммиак вызывает раздражение глаз и слизистой оболочки носа, тошноту и головные боли. Все работы с аммиаком должны проводиться в вытяжном шкафу.
Из баллонного аммиака. Собирают установку (рис. 7.19). Баллон с аммиаком 1 устанавливают и закрепляют на подставке 2. Баллон соединяют с пустой промежуточной склянкой 3, к которой присоединены две поглотительные склянки 4 с раствором NaOH для поглощения СO2. Аммиак, очищенный от СO2, поступает в приемник 5, где находится дважды перегнанная дистиллированная вода, не содержащая СO2. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
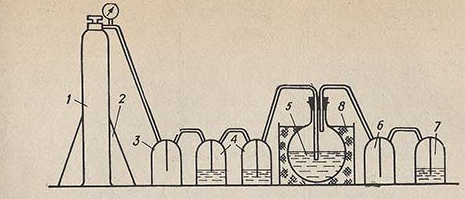
Рисунок 7.19. Установка для приготовления раствора аммиака из баллонного газа
Для получения более концентрированного раствора приемник охлаждают водой со льдом в бане 8.
Склянка 6 — брызгоуловитель; склянка 7, содержащая раствор NaOH, предохраняет от попадания СO2 из воздуха в приемник.
Из водного аммиака. 500 мл водного аммиака помещают в круглодонную колбу вместимостью 1 л и осторожно прибавляют свежеприготовленную кашицу из 10 г СаО и воды.
Колбу соединяют с вертикально поставленным обратным холодильником, верхний конец которого закрывают трубкой с натронной известью, и оставляют раствор в покое на 18-20 ч. Затем собирают установку. Колбу 2 с водным аммиаком ставят на водяную баню 1 так, чтобы холодильник был направлен вверх под углом 45°, и соединяют верхний его конец через промежуточную колбу 4 с приемником — колбой 5, содержащей 300-400 мл воды, и закрытой трубкой с натронной известью 6. При нагревании водного аммиака на водяной бане газообразный аммиак поступает в приемник и полностью поглощается водой. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
Приготовление рабочих растворов точной концентрации
Приготовление раствора из навески стандартного вещества
Взятую с точностью до 0,0002 г навеску высушенного стандартного вещества, которая приблизительно соответствует рассчитанной для получения определенного объема раствора заданной концентрации, аккуратно переносят в мерную колбу и растворяют в небольшом объеме дистиллированной воды, не содержащей СO2. Полученный раствор при периодическом взбалтывании разбавляют водой, доводя объем раствора в мерной колбе несколько ниже метки. Затем колбу с раствором выдерживают 15-20 мин при 20°С и осторожно добавляют воду до метки. Колбу закрывают пробкой и содержимое взбалтывают в течение 15-30 мин.
Зная массу исходного вещества и объем раствора, вычисляют его концентрацию.
Для упрощения последующих расчетов удобно пользоваться поправкой на нормальность (или коэффициентом нормальности) К. Эта поправка представляет собой отношение нормальности приготовленного раствора к заданной нормальности раствора, выраженной целыми, десятыми или сотыми долями нормальности. Например, нормальность приготовленного раствора оказалась равной 0,1036 н., а заданная 0,1 н. В этом случае
![]()
При умножении объема пошедшего на титрование раствора на эту поправку К получают эквивалентный объем заданной концентрации (в данном случае 0,1 н.).
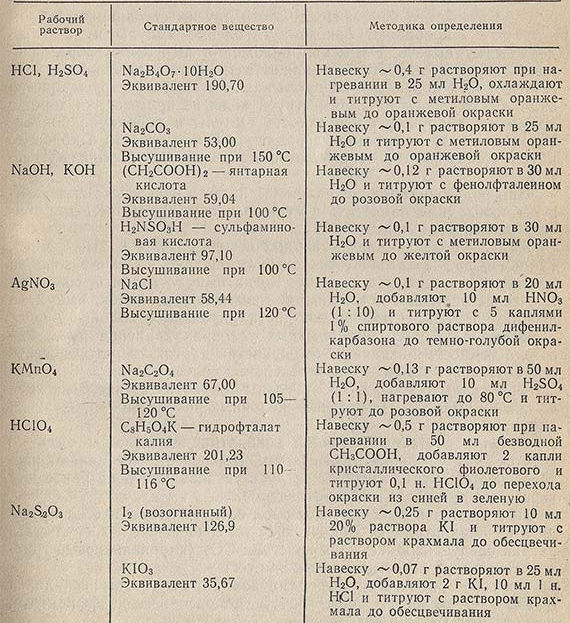
В табл. 7.3 приведены некоторые твердые стандартные вещества, с помощью которых точно устанавливается концентрация наиболее часто применяемых рабочих растворов.
Таблица 7.3. Стандартные вещества и рабочие растворы
Приготовление растворов из фиксаналов
Фиксаналы, или стандарт-титры, представляют собой точно отвешенное количество реактива или его раствора, запаянного в стеклянную ампулу. Как правило, в каждой ампуле содержится 0,1 эквивалента вещества. При количественном перенесении содержимого подобной ампулы в мерную колбу на 1 л и доведении объема раствора водой до метки при 20°С получаются точно 0,1 н. растворы.
Выпускаются фиксаналы HCl, H2SO4, NaOH, КОН, Na2CO3, NaCl, Na2C2O4, H2C2O4-2H2O, K2Cr2O7, K2C2O4, Na2S2O3-5H2O, KMnO4, AgNO3, NH4SCN, KSCN, NaSCN, BaCl2-2H2O, (NH4)2C2O4-H2O, Na2B4O7-10H2O, KCl, K2CO3, NH4Cl, I2 и др.
Фиксаналы рекомендуется применять во всех случаях, когда требуется быстро приготовить точный рабочий раствор, не прибегая к взвешиванию.
Вначале теплой водой смывают надпись на ампуле и хорошо обтирают ее чистым полотенцем. В мерную колбу вместимостью 1 л вставляют воронку с вложенным в нее стеклянным бойком (обычно прилагается к каждой коробке фиксанала), острый конец которого должен быть обращен вверх (рис. 7.20). Ампуле с фиксаналом дают свободно падать так, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого другим стеклянным бойком пробивают боковое углубление ампулы и дают содержимому вытечь. Не меняя положения ампулы, в образовавшееся верхнее отверстие вставляют оттянутый в капилляр и изогнутый вверх конец трубки промывалки и сильной струей промывают ампулу изнутри. Затем струей воды из промывалки хорошо промывают наружную поверхность ампулы и воронку с бойком. Удалив ампулу из воронки, доводят уровень жидкости в колбе до метки. Колбу плотно закрывают и тщательно перемешивают раствор.
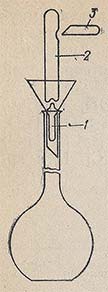
Рисунок 7.20
При пользовании фиксаналом 0,1 н. йода перед вскрытием ампулы необходимо поместить в мерную колбу 30-40 г KI для полного растворения йода.
Ампулы с фиксаналами твердых веществ (H2C2O4-2H2O, NaCl, KMnO4 и др.) вскрывают так же, как описано выше, но воронка должна быть совершенно сухая. Когда ампула разбита, содержимое ее осторожным встряхиванием высыпают в колбу, ампулу и воронку тщательно промывают дистиллированной водой.
Фиксанал AgNO3 при обычных условиях хранения через 2-3 года темнеет. Фиксаналы большинства других твердых веществ и кислот могут храниться неопределенно долгое время.
Фиксаналы NaOH, КОН пригодны только в течение 6 месяцев со дня их выпуска. Помутнение щелочных растворов — признак их порчи.
Рабочие растворы с точной концентрацией должны быть по возможности свежеприготовленными. Исключение составляют растворы KMnO4, титр которых следует устанавливать не ранее чем через 3-4 дня после их приготовления.
При хранении рабочих растворов следует периодически проверять их концентрацию. Рабочие растворы щелочей и тиосульфата натрия следует защищать от действия СО2 (хлоркальциевые трубки с натронной известью или аскаритом).
Сосуды с рабочими растворами должны иметь четкие надписи с указанием вещества, нормальности, поправочного коэффициента, даты изготовления и даты проверки концентрации.
Техника приготовления растворов
Независимо от того, какие (поточности) приготовляют растворы, применять следует только чистые растворители. Если растворителем служит вода, то можно применять только дистиллированную или деминерализованную воду, а в отдельных случаях даже бидистиллят или специально очищенную дистиллированную воду.
Предварительно подготавливают соответствующей емкости посуду (см. ниже), в которой будут готовить и хранить получаемый раствор. Посуда должна быть чистой. Если есть опасение, что водный раствор может взаимодействовать с материалом посуды, то посуду внутри следует покрыть церезином, парафином или другими химически стойкими веществами.
Пример. Если нужно приготовить I л какого-то раствора, то для растворения следует взять посуду емкостью ие больше 1,5 л. Если готовят 10 л раствора, то бутыль должна быть емкостью не больше 12-13 л.
Перед приготовлением растворов нужно подготовить по возможности два одинаковых сосуда: один — для растворения, а другой — для хранения раствора. Может случиться, что раствор нужно будет отфильтровывать от какого-либо осадка или примеси, не растворившейся в данных условиях.
Вымытый сосуд полезно предварительно проградуировать (рис. 7.21). Это особенно касается бутылей большой емкости. Градуирование проводят следующим образом: мерным цилиндром отмеривают 1 л воды и переливают ее в бутыль. На стенке бутыли восковым карандашом проводят черту, совпадающую с уровнем воды в бутыли, и ставят цифру 1. Затем наливают второй литр воды и уровень отмечают цифрой 2. Так проделывают до тех пор, пока бутыль не будет заполнена до плеча. Расстояние между цифрами, обозначающими целые литры, можно разделить пополам более короткой чертой. Каждая такая черта будет соответствовать 0,5 л.
Для растворения следует применять по возможности чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют растворы, т. е. добавляют в них недостающее количество вещества или воды.
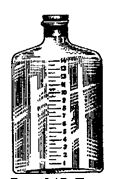
Рисунок 7.21. Градуированная бутыль
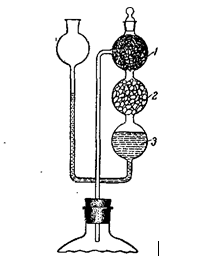
Рис. 7.22. Приспособление для хранения растворов в атмосфере двуокиси углерода: 1— стеклянное волокно; 2 —мрамор; 3- раствор соляной кислоты
Нужно принимать меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Так, Щелочи следует защищать от двуокиси углерода, для этого бутыль с щелочью снабжают хлоркальциевой трубкой, заполненной натронной щелочью или аскаритом.
Как во время приготовления растворов, так и при их хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками.
При особо точных и ответственных анализах следует обязательно принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду или такую, стекло которой не содержало бы искомый элемент. Так, неизбежна ошибка при определении бора, цинка, алюминия, свинца и некоторых других элементов в посуде из стекла, содержащего эти элементы.
В некоторых случаях растворы следует хранить в атмосфере инертного газа, как азот, или в атмосфере двуокиси углерода. Для этого существуют специальные устройства или особые бюретки, приспособленные для каждого случая титрования.
Для хранения растворов в атмосфере двуокиси углерода в бутыль с раствором вставляют на пробке прибор, изображенный на рис. 7.22. В среднюю, расширенную, часть его насыпают куски мрамора среднего размера (как для аппарата Киппа), верхний шар заполняют стеклянным волокном. Через боковую воронку в прибор наливают раствор соляной кислоты, разбавленной 1 :2. Если из бутыли через тубус выливать жидкость, то над уровнем жидкости создается вакуум, и раствор соляной кислоты перемещается в средний шар. В результате начинается реакция с мрамором и образовавшаяся двуокись углерода поступает в бутыль. Когда в бутыли создается небольшое давление, соляная кислота переместится в нижний шар и выделение газа прекратится.
Щелочные растворы нельзя оставлять надолго в фарфоровой и особенно — в стеклянной посуде. Если приходится их оставлять, то необходимо вначале нейтрализовать растворы, потом немного подкислить и хранить только подкисленные растворы. При этом растворы лучше оставлять в фарфоровой посуде, а не в стеклянной.
Существует несколько способов приготовления растворов.
По способу приготовления различают первичные и вторичные стандартные растворы.
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
состав их должен строго соответствовать химической формуле;
вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом. Основные этапы работы:
рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г;
взвешивают точную навеску на аналитических весах;
взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя химические формулы.
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Сэкв 1·V1 = Cэкв 2·V2
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными;
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество nэкв вещества в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают;
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты ведут с точностью не более чем до 0,01, точную концентрацию устанавливают титрованием и рассчитывают по формуле.
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора;
Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации — кг/м3, г/л;
Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3;
Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М;
Молярная концентрация эквивалентов сэк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2H2SO4) = 1 моль/л, сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н;
Моляльность b — это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности — моль/кг. Например, b(HCl/H2O) = 2 моль/кг;
Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1).
Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду:
мерные колбы;
пипетки;
бюретки.
Экспериментальная часть
Опыт 1. Приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора.
Как известно, плотность – это масса вещества в единице объема, ρ = m/v. Зная плотность, можно по таблице определить массовую долю (%) раствора.
Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра.
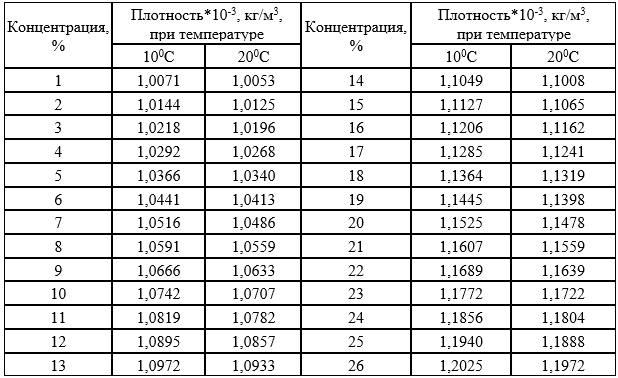
Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке — нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в таблице 7.4.
Выполнение опыта. В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 7.4 находят концентрацию исходного раствора [в % ( масс) ].
Таблица 7.4 – Плотность и процентное содержание растворов хлорида натрия
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
![]()
где С – заданная концентрация;
С1- полученная концентрация.
Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 7.5.
Таблица 7.5. Опытные данные
Пример 1
Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3.
По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3.
Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора.
Масса его составляет 500![]() 1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно
![]() г.
г.
Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4:
1 мл исходной кислоты содержит ![]() г H2SO4
г H2SO4
![]() х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4
![]() мл
мл
Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора.
Количество воды определяется как разность весов полученного исходного раствора, а именно ![]() мл
мл
Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации.
Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Пример 2
Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты.
Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение:
![]()
откуда
![]()
Следовательно, необходимо взять 60г 44% раствора ![]() и 100 — х = 40г 24% раствора.
и 100 — х = 40г 24% раствора.
Выполнение опыта
Приготовить 250 мл 10% раствора хлорида натрия, имея в своем распоряжении 15% и 5% раствор NaCl.
Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15% и 5% раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.7.4. найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн.
Опыт 3.Приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески.
Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия, взятого для приготовления 250 мл раствора.
Пример 3.
Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3. Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора
![]()
![]()
Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора:
100 г раствора — 1 г NaCl
201,315 г раствора — х г NaCl
х =![]() г NaCl
г NaCl
Таким образом, была взята навеска NaCl массой 2,0131 г.
Растворы процентной концентрации
Приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
в весовых процентах, т.е. по количеству граммов вещества, содержащегося в 100 г раствора;
в объемных процентах, т.е. по количеству единиц объема (мл) вещества в 100 мл раствора;
молярностью, т.е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
нормальностью, т.е. количеством грамм-эквивалентов раствореного вещества в 1 л раствора.
Растворы процентной концентрации
Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
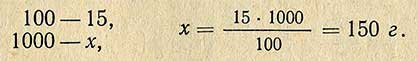
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1,184 = 1184 г.
Тогда следует:
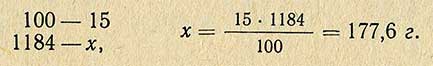
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1,050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
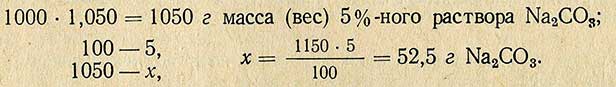
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
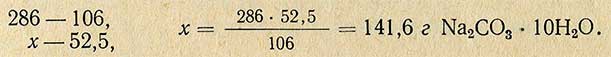
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1,185 (37,3%). Относительная плотность 10%-ного раствора 1,047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1,047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
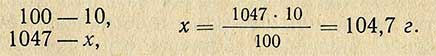
Чтобы определить, сколько необходимо взять 37,3%-ной кислоты, составляем пропорцию:
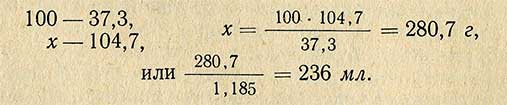
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева — концентрация исходных растворов, для растворителя она равна нулю.


Растворы занимают промежуточное место между механическими смесями и химическими соединениями. Однородность растворов и выделение теплоты при растворении некоторых веществ делает их сходными с химическими соединениями. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких приделах.
Кроме того, в свойствах раствора можно обнаружить свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Давление насыщенного пара над раствором
Переход молекул веществ из жидкости в пар называется испарением. Переход молекул вещества из парообразного состояния в жидкость называется конденсацией.
Если жидкость находится в замкнутом сосуде, то достигается равновесие, когда скорость испарения жидкости равна скорости конденсации пара.
Давление, которое оказывает пар, находящийся в равновесии с жидкостью, называют давление насыщенного пара этой жидкости. Это максимальное давление пара, которое развивается жидкостью. Давление насыщенного пара зависит от природы жидкости и температуры и не зависит от количества жидкости.
Поверхность раствора, в отличие от поверхности чистого растворителя, частично занята молекулами растворенного вещества. Поэтому число молекул растворителя, испаряющихся в единицу времени с единицы поверхности раствора меньше, чем с единицы поверхности растворителя. Следовательно, при одной и той же температуре давление насыщенного пара над раствором всегда будет ниже давления насыщенного пара над растворителем.
Количественно эта зависимость выражается законом Ф. Рауля «В идеальных растворах при постоянной температуре величина относительного понижения давления пара растворителя над раствором равна молярной доле растворенного вещества».
![]()
где Р0 – давление пара чистого растворителя;
Р — давление насыщенного пара над раствором.
Идеальный раствор– раствор, в котором межмолекулярные силы равны. Если вещества А и В образуют идеальный раствор, то силы между молекулами А…А, А…В и В…В равны.
Из закона Рауля следует, что пар над смесью жидкостей А и В содержит оба этих вещества, причем давление насыщенного пара каждого из веществ в смеси равно произведению мольной доли этого вещества на давление насыщенного пара над чистым веществом, т.е.:
РА=NА* Р0А
РА– давление насыщенного пара вещества А над раствором;
NА– мольная доля вещества А в растворе;
Р0А– давление насыщенного пара вещества А над чистым веществом.
Для вещества В РВ=NВ* Р0В
Температура кипения и температура замерзания (кристаллизации) раствора
Температура замерзания (кристаллизации) жидкости – это температура, при которой давление насыщенного пара жидкости равно давлению насыщенного пара кристаллов.
Так как согласно закону Ф. Рауля, давление насыщенного пара над раствором нелетучего вещества ниже давления пара над чистым растворителем, следовательно, при одном и том же внешнем давлении температура кипения раствора выше температуры кипения чистого растворителя, а температура замерзания раствора ниже температуры замерзания чистого растворителя.
Количественно эта зависимость установлена законом Ф. Рауля «Повышение температуры кипения или понижение температуры замерзания идеального раствора прямо пропорционально моляльной концентрации растворенного вещества».
∆Ткип.= Е*См, ∆Тзам.= К*См
где См– моляльная концентрация раствора, мол/Кг;
Е – эбулеоскопическая постоянная, град/мол;
К – криоскопическая постоянная, град/мол.
Е и К показывают повышение температуры кипения и понижение температуры замерзания раствора, в котором в 1 кг растворителя растворен 1 моль вещества.
Пример 1: для воды Е = 0,52 град/мол, К = 1,86 град/мол.
Так при растворении в 1000 г воды 342 г сахара (С12Н22О11) или 46 г этилового спирта (С2Н5ОН) температура замерзания каждого раствора понизится на 1,860.
Например: определить температуру замерзания 40 % масс. водного растворителя глицерина (С3Н8О3). 100 г раствора состоит из 40 г глицерина и 60 г воды. Таким образом на 1000 г воды (растворителя) содержится 666 г глицерина. Молекулярная масса С3Н8О3равна 92. Моляльная концентрация раствора 666/92 = 7,24 моля/кГ
∆Тзам.= 1,86*7,24 = 13,50
Ответ: температура замерзания 40 % водного раствора глицерина – 13,50С.
Пример 2: раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,2790С. Вычислите мольную массу глицерина.
Решение: температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации Δt= 0- (-0,2790) = 0,2790. Масса глицеринаm(г), приходящаяся на 1000 г воды,
m= 11,04*1000/800 = 13,8
подставляем значение mв уравнение
![]() ,
,
тогда мольная масса глицерина
М = 1,86*13,8/0,279 = 92 г/моль
В измерениях температур кипения и замерзания растворов основаны эбуллиоскопические и криоскопические методы определения молекулярных масс веществ. При этом используют формулу:
![]()
К – криоскопическая или эбулеоскопическая константа;
mи М– соответственно масса растворенного вещества и его мольная масса;
m1– масса растворителя.
Одни вещества в растворенном или расплавленном состоянии проводят эдектрический ток (электролиты), другие в тех же условиях эл. ток не проводят (не электролиты).
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от концентрации частиц в растворе. Значение коллигативных свойств растворов, получающихся при растворении электролитов, аномально высоки.
Например: При растворении 1 моля хлорида натрия в 100 г воды понижение температуры замерзания раствора составляла не 1,86°, а 3,36°, т.е. примерно в два раза больше теории.
Полученные экспериментальные данные приводят к выводу о распаде (диссоциации) молекул электролита в растворе на более мелкие частицы (ионы).
Теория электролитической диссоциации создана С. Аррениусом. Основные положения этой теории:
при растворении электролитов происходит диссоциация их молекул на заряженные частицы — ионы;
при диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами;
величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов;
в целом раствор нейтрален. Растворы электролитов проводят электрический ток — «проводники второго рода».
Согласно современной теории растворов диссоциация происходит в результате взаимодействия растворенного вещества с молекулами растворителя. Хорошо диссоциируют молекулы с ионной и ковалентной полярной связью. Неполярные и малополярные молекулы не диссоциируют или диссоциируют очень мало. На диссоциацию электролитов в значительной степени влияет полярность растворителя. Чем выше полярность растворителя, тем выше степень диссоциации электролита.
Диссоциация кислот
НСl = Н+ + Сl-
Н2SO4 = 2Н+ + SO2-4
СНзСООН ↔ СНзСОО-
С точки зрения электрической диссоциации кислотами называются электролиты, образующие в водных растворах ионы водорода (Н+).
Диссоциация оснований
NaOH=Na+ +OH-
Ва(ОН)2 = Ва2+ + 2ОН-
NН4ОН ↔ NН+4 + ОН-
Основаниями называются электролиты, диссоциирующие в водном растворе с образованием гидроксид-ионов (ОН).
Диссоциация солей
NaCl = Na+ +Cl-
NiSO4 = Ni2+ + SO2-4
K3PO4=ЗK++POЗ-4
Сильные и слабые электролиты
Изучение коллигативных свойств растворов электролитов показало, что в растворах присутствуют наряду с ионами и молекулы (диссоциация про исходит не полностью), т.е.
КА ↔ К+ +А-
Долю диссоциированных молекул характеризует степенью диссоциации (α). Степень диссоциации — отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул N:α = n/N
Например: α = 20 %. Это значит, что из 100 молекул электролита 20 молекул распалось на ионы, КА K+ +А- и в растворе присутствует 40 ионов, а также 80 не распавшихся молекул. Всего в растворе будет присутствовать 120 частиц.
Электролиты имеют различную степень диссоциации, которая зависит от концентрации электролита, от температуры. С уменьшением концентрации и повышением температуры степень диссоциации возрастает. Все электролиты по степени диссоциации делятся на сильные и слабые. Условно электролиты, для которых при концентрации растворов 0,01-0,1 н, степень диссоциации больше 50 % относят к сильным, а для которых меньше, чем 50 % — к слабым.
К сильным электролитам относятся:
СОЛИ, растворимые в воде,
ОСНОВАНИЯ элементов 1 и 2 групп главных подгрупп.
КИСЛОТЫ HCI, HBr, HJ, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
К слабым электролитам относятся:
СОЛИ, нерастворимые в воде,
ОСНОВАНИЯ НЕРАСТВОРИМЫЕ в воде, NH4ОН,
КИСЛОТЫ органические (СН3СООН), Н2S, Н2СО3, Н2SiО3, Н3ВО3.
Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы; слабые ионы лишь частично.
Чтобы исключить влияние концентрации электролита для характеристики диссоциации используют константу диссоциации, т.к. диссоциация является обратимым процессом, то согласно закону действующих масс;
Например, в водном растворе уксусной кислоты устанавливается равновесие:
![]()
![]()
Константа равновесия в этом случае характеризует электролитическую диссоциацию и называется константой диссоциации /Кд/. Кд зависит от температуры и не зависит от концентрации раствора. По величине Кд можно судить о силе электролита.
Например: для одной и той же температуры Кд(NH4ОН) = 1,79*10-5; Кд(СН3СООН) = 1,75*10-5; Кд(НСN) = 4,79*10-10.
Самым слабым электролитом является НСN.
Ионное произведение воды
Вода является очень слабым электролитом. Электролитическая диссоциация воды выражается следующим уравнением:
Н2О ↔ Н++ ОН-
Это обратимый процесс. Константа диссоциации запишется:
Кд= [Н+]*[ ОН-]/[ Н2О]
тогда Кно= [Н+] [ОН-]
Кно называется ионным произведением воды.
Это уравнение показывает, что для воды при постоянной температуре, произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
При 220С [Н+] [ОН-] = 10-14мол/л. В воде [Н+] = [ОН-] = 10-7мол/л.
В зависимости от концентрации ионов водорода различают нейтральную, кислую и щелочную среду (растворы):
Растворы, в которых [Н+] = 10-7мол/л – нейтральные растворы;
[Н+] -7мол/л (10-8, 10-9и т.д.) – щелочные;
[Н+] 10-7мол/л (10-6, 10-5и т.д.) – кислые.
Например: в 0,01 М растворе НСlпри 250С [Н+] = 0,01 = 10-2мол/л, т.к. НСl– сильный электролит и α = 1, при этом концентрация гидроксид-ионов: [ОН-] = Кно/[Н+] = 10-14/10-2мол/л.
Для характеристики среды пользуются не значением концентрации ионов водорода ([Н+]), а величиной водородного показателя (рН).
рН = -lg[Н+]
рН = 7 – нейтральная среда;
рН
рН 7 – щелочнач среда.
Например: для 0,01 М раствора НСlрН = -lg10-2= 2;
для 0,01 М раствора NаОН рН = -lg10-12= 12.
Шкала кислотности растворов
рН = 0-2 – сильнокислые;
рН = 3-4 – умеренно кислые;
рН = 5-6-слабокислые;
рН = 7 – НЕЙТРАЛЬНЫЕ;
рН = 8-9 – слабощелочные;
рН = 10-11 – умеренно щелочные;
рН = 12-14 – сильнощелочные.
Ионные уравнения реакций. Реакции в растворах
Реакции в растворах электролитов протекают между ионами и идут практически необратимо, если в результате реакции образуются осадки, газы, слабые электролиты. Обычно такие реакции изображаются при помощи ионных уравнений. В ионных уравнениях малорастворимые, мало диссоциированные и газообразные соединения пишутся в виде молекул, хорошо растворимые электролиты пишутся в виде ионов.
Рассмотрим примеры:
1.
AgNO3+ КСl=AgCl↓ +KNO3– молекулярное уравнение
осадок
Ag++NO3 -+ К++ Сl-=AgCl↓ + К++NO3-- полное ионно-молекулярное уравнение
Ag++ Сl-=AgCl↓ — сокращенное ионно-молекулярное уравнение.
Сокращенное ионно-молекулярное уравнение выражает сущность протекающей реакции;
2.
2НСl + Na2S = Н2S↑ + 2NaCl
2Н++ 2Сl-+ 2Na++S2-= Н2S↑ +2Na++2Сl-
2Н++S2-= Н2S↑
3.
2КСN+ Н2SO4= 2НСN+ К2SO4
слабый электролит
2К++ 2СN-+ 2Н++SО42-= 2НСN+ 2К++SО42-
2СN-+ 2Н+=2НСN
4.
NaСl+ КNO3= КСl+NaNO3
Na+ + Сl- + NO3 — + К+ = К+ + Сl- + Na+ + NO3-
В этом случае нет никакой реакции, т. к. ионы не образуют веществ, уходящих из зоны реакции (осадок, газ, малодиссоциирующее вещество).
5. Нередко встречаются обратимые процессы, в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой — слабый электролит.
Mg(ОН)2 +2НСl=MgCl2+2Н2О
Mg(ОН)2+ 2Н++ 2Сl- =Mg+2+ 2Сl-+2Н2О
Mg(ОН)2+ 2Н+=Mg+2+2Н2О
Так равновесие в системе смещено вправо, поскольку ионы ОН-связываются в малодиссоциированные молекулы воды полнее, чем в гидроксиде магния.
Гидролизом соли называется реакция обменного взаимодействия соли с водой, в результате чего нарушается равновесие диссоциации воды:
Н2О ↔ Н++ ОН-
Любая соль состоит из катиона и аниона, которые могут связывать ион Н+и ОН-из воды, смещая равновесие и изменяя характер среды.
Соли можно рассматривать как продукты реакции нейтрализации:
нейтрализация
Кислота + основание соль + вода
Кислоты и основания, образующие соли, могут быть сильными и слабыми, поэтому возможны четыре вида солей:
В случае солей, образованных сильными кислотами и сильными основаниями (СаСl2,NаSО4,NaNО3, КСlи др.) ни катионы, ни анионы не будут связывать ионы в малодиссоциированные продукты, поэтому равновесие ионов Н+и ОН-не нарушается. Гидролиз не идет, раствор нейтрален (рН = 7), индикатор окраски не меняет;
Гидролиз солей, образованных сильными кислотами и слабыми основаниями (FеСl3, СuSО4,NН4Сl, Вi(NО3)3и др.). В этом случае катион соли будет связывать ионы ОН-из воды, вследствие чего в растворе будут накапливаться ионы Н+:NН4++ Н2О ↔NН4ОН + Н+, поэтому раствор приобретает кислую реакцию (рН 7). Если катион многозарядный, то гидролиз пойдет ступенчато. Рекомендуется следующий порядок в написании таких уравнений:
сокращенное ионное уравнение;
молекулярное уравнение.
Рассмотрим гидролиз FeCl3. Он будет протекать по катиону в три ступени:
I ступень Fе3++ Н2О ↔FeОН2++ Н+;
FeCl3+ Н2О ↔FeОНСl2+ НСl.
II ступень FeОН2++ Н2О ↔Fe(ОН)+2+ Н+;
FeОНСl2+ Н2О ↔Fe(ОН)2Сl+ НСl.
III ступень Fe(ОН)+2+ Н2О↔Fe(ОН)3+ Н+;
Fe (ОН)2Сl+ Н2О↔Fe(ОН)3+ НСl.
На всех трех ступенях гидролиз протекает по катиону, среда кислая (рН
Гидролиз солей, образованных сильными основаниями и слабыми кислотами (Na2CO3, К2S,Na3РО4, СН3СООН и др.). в этом случае анион соли связывает ионы Н+из воды, в растворе накапливаются ионы ОН-, сообщая ему щелочную среду (рН7). Если анион многозарядный, то гидролиз идет ступенчато.
Рассмотрим гидролиз Na3РО4, он будет протекать по аниону в 3 ступени:
I ступень РО3-4+ Н2О ↔ НРО2-4+ ОН-,
Na3РО4+ Н2О ↔Na2НРО4+NaОН.
II ступень НРО2-4+ Н2О ↔ Н2РО-4+ ОН-,
Na2НРО4+ Н2О ↔NaН2РО4+NaОН.
III ступень Н2РО-4+ Н2О↔ Н3РО4+ ОН-,
NaН2РО4+ Н2О↔ Н3РО4+NaОН.
На всех трех ступенях гидролиз идет по аниону, среда щелочная (рН7). Преобладает I ступень гидролиза;
Гидролиз солей, образованных слабыми кислотами и слабыми основаниями (Аl2S3,Fе(СН3СОО)3, (NН4)2Sи др.). В этом случае и катионы и анионы соли связывают ионы ОН- и Н+из воды, т.е. идет гидролиз по катиону и по аниону. Рассмотрим гидролиз ацетата аммония:
NН+4+ Н2О ↔NН4ОН + Н+,
СН3СОО-+ Н2О ↔ СН3СООН+ ОН-,
NН+4+ СН3СОО-+ Н2О ↔NН4ОН + СН3СООН
NН4СН3СОО + Н2О ↔NН4ОН + СН3СООН
Гидролиз идет по катиону и по аниону, среда нейтральная (рН=7).
Если смешать растворы двух солей, образованных катионом слабого основания и анионом слабой кислоты, произойдёт совместный необратимый гидролиз:
2СrСl3+ 3Na2S+6Н2О ↔ 6NаСl+ 2Сr(ОН)3↓ + 3Н2S↑
На равновесие гидролиза влияет температура и концентрация. Смещение равновесия гидролиза происходит в соответствии с принципом Ле-Шателье. Гидролиз – это реакция, обратная нейтрализации, а нейтрализация – экзотермический процесс, следовательно, гидролиз – эндотермический. Поэтому увеличение температуры усиливает гидролиз (т.е. смещает равновесие вправо). Гидролиз усиливается при разбавлении водой и при удалении продуктов гидролиза. Гидролиз подавляется (равновесие смещается влево), если увеличивать концентрацию продуктов гидролиза. Гидролиз может протекать необратимо, если продукты гидролиза уходят из сферы реакции (выпадение осадка, выделение газа):
t
FеСl3+ 3Н2О ↔Fе(ОН)3+ 3НСl
добавление щелочи
NН4Сl+ Н2ОNН4ОН + НСl
добавление кислоты












