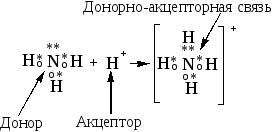Тема урока «Аммиак: физические и химические свойства, получение и применение»
Цель урока. Установить причинно-следственные связи между строением молекулы аммиака и его свойствами, получение и применение. Рассмотреть донорно-акцепторный механизм образования ковалентной связи.
Планируемые результаты обучения
Предметные. Знать механизм образования механизм образования ковалентной связи в молекуле аммиака и катионе аммония, химические свойства аммиака. Уметь составлять уравнения реакций, характеризующих химические свойства аммиака, и разъяснять их с точки зрения представлений об электролитической диссоциации и окислительно-восстановительных процессах. наблюдать и описывать демонстрируемые химические эксперименты, делать выводы и умозаключения из наблюдений, структурировать изученный материал, фиксировать его в рабочей тетради.
Метапредметные. Формировать умения создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач.
Личностные. Формировать целостное мировоззрение, соответствующее современному уровню развития науки.
Основные виды деятельности учащихся.
Составлять схему образования иона аммония. Характеризовать физические свойства аммиака на основе наблюдения демонстрационного опыта получения аммиака. Объяснять реакции горения аммиака в кислороде и окисления кислородом в присутствии катализатора с точки зрения представлений об окислительно-восстановительных процессах.
Место урока в структуре учебных занятий: раздел «Многообразие веществ», глава: «Азот и фосфор», урок второй.
Тема урока: «Аммиак».
Ресурсы (основные):Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия 9 класс. Базовый уровень. - М: Просвещение.- 2014
Дополнительные: сеть Интернет.
Оборудование учителя: компьютер, видеоопыты, онлайн-тесты.
Оборудование учащихся: ПСХЭ, таблица растворимости.
Ход урока
I.Организационный момент
II.Актуализация знаний
1.Фронтальный опрос
1.Что общего в строении элементов VA группы?
2.Назовите высшую и низшую степени окисления элементов VA группы
3.Как изменяются неметаллические свойства простых веществ в главных подгруппах?
4.Описать физические свойства азота
5.В чем причина химической инертности азота?
6.При каких условиях азот вступает в реакции с другими веществами?
Для изучения новой темы нужно повторить строение молекулы азота.
III.Работа по теме урока
Создание проблемной ситуации.
Сегодня на уроке мы познакомимся с удивительным веществом с уникальными свойствами. Его использование может принести пользу или навредить.
Итак, эта история произошла во время I мировой войны. Английский крейсер вел преследование повреждённого в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма, появился удушливый запах, раздражающий горло, стало трудно дышать. Крейсер был вынужден дать задний ход и выйти из дымового облака. Позже обнаружили, что пострадали не только люди, но и металлические части корабля. Что же это было за едкое облако и какой газ почувствовали люди?
Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно. Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала это вещество называли аммониак, а потом сократили название до «аммиак». В средние века этот газ называли «щелочной воздух», а его раствор и сейчас называют «нашатырный спирт».
Вещество, о котором пойдёт речь на нашем уроке – аммиак.
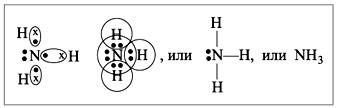
1. Строение молекулы
Формула аммиака NH3 , химическая связь между атомами азота и водорода- ковалентная полярная
 Слайд 1.
Слайд 1.
Учитель обращает внимание на не поделенной электронной паре атома азота
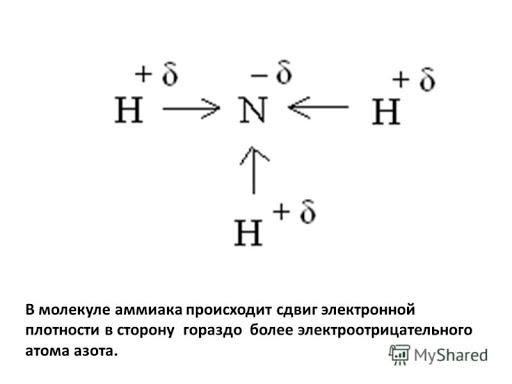 Слайд 2.
Слайд 2.
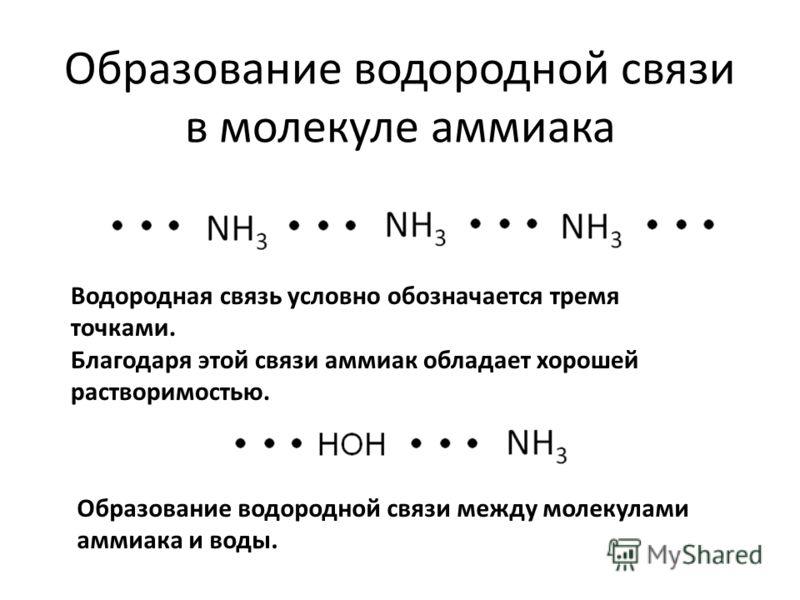
Далее учитель объясняет новый вид химической связи-водородная, которая возникает между молекулами аммиака
Слайд 3.
2.Физические свойства аммиака
Проведение демонстрационного опыта по получению аммиака.
Нагревание смеси хлорида аммония с гидроксидом кальция.
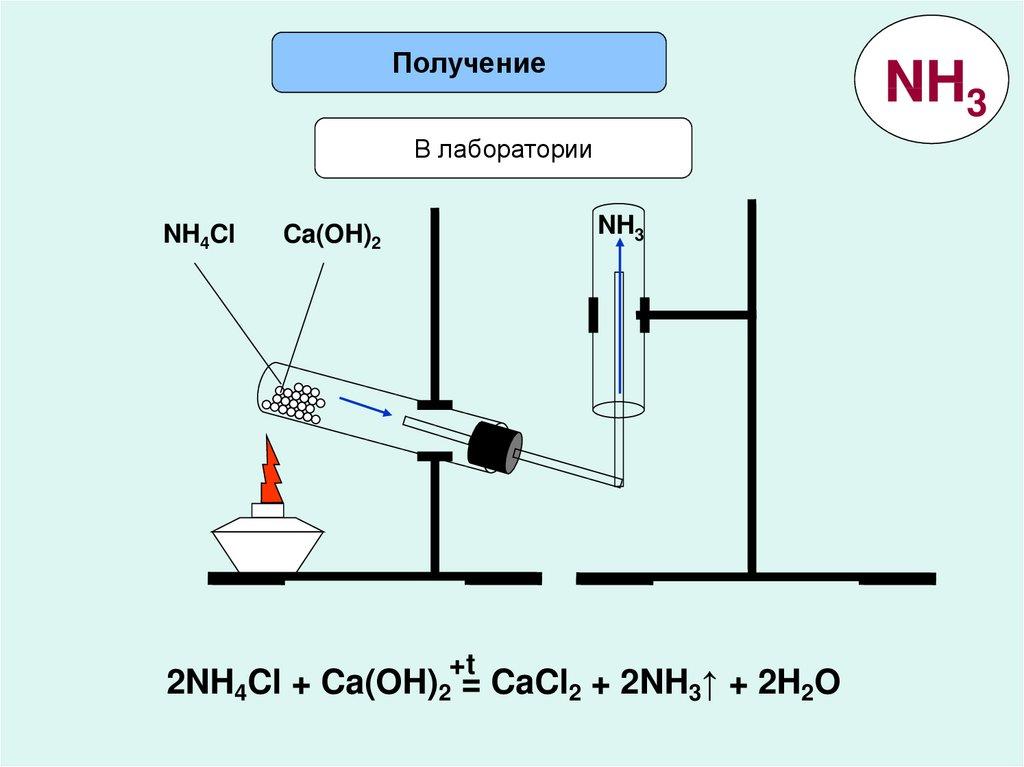
Почему пробирку для собирания аммиака держим вверх дном? Ответы учеников.
Рассчитываем плотность аммиака по воздуху:
Имеет ли газ специфический запах? (Характерный резкий запах, токсичен)
Объяснение учителем: Физиологическое влияние на организм человека.
Относится к группе веществ удушающего действия, способных вызывать токсический отёк лёгких и тяжёлые поражения нервной системы. Пары сильно раздражают слизистые оболочки глаз и органы дыхания, а также кожные покровы. Вызывают обильное слёзотечение, боль в глазах, хим. ожог роговицы, потерю зрения, приступы кашля.
К каким последствиям приводит нахождение людей в помещении с высокими концентрациями аммиака?
3.Химические свойства аммиака
Полученный аммиак растворяют в воде, в которую добавляем фенолфталеина. Раствор аммиака окрашивается в малиновый цвет. Учащиеся делают вывод,что при растворении аммиака в воде образуется щелочь.
В 1 объеме воды растворяется 700 объемов аммиака.
Видео - Эксперимент: "Фонтан"
Назвать причину такой хорошей растворимости.( Образование водородной связи между молекулами аммиака и воды).
NH3+H2O⇄NH3⋅H2O⇄NH;4++OH-.
Учитель демонстрирует классу аммиачную воду.
Учитель напоминает классу как правильно обращаться с растворами с резким запахом.
Далее учитель нагревает окрашенный фенолфталеином раствор аммиака.
Учащиеся отмечают, что раствор обесцвечивается.
Почему это происходит? Делают вывод: исходя из уравнения реакции (равновесие реакции смещается влево) водный раствор стал нейтральным, а не щелочным.
Отсюда вывод: водный раствор аммиака легко разлагается, он является слабой щелочью и может проявлять характерные свойства этого класса соединений.
Рассмотрим подробнее ион аммония NH4+. Этот катион образован неметаллами, а играет роль металла. Ион аммония. как и ионы металлов, образует свои соли.
Видео - Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
NH3 + HCl = NH4Cl хлорид аммония
Задание учащимся : опровергните пословицу «Не бывает дыма без огня».
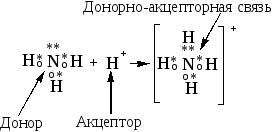
Анимация: “Донорно-акцепторнорный механизм”
Вводится понятие донора (N) и акцептора (H+ ),следует отметить равноценность всех 4 ковалентных полярных связей в ионе аммония. Нужно обратить внимание учащихся на валентности атома азота (IV) и на его степень окисления (-3),
Восстановительные свойства аммиака.
-окисление аммиака без катализатора
4NH3 + 3O2 → 2N2 + 6H20
Учащиеся рассматривают данную реакцию с точки зрения представлений об окислительно-восстановительных процессах.
-окисление аммиака в присутствии катализатора.
4NH3 + 5O2 → 4NO + 6H2O
Учащиеся рассматривают данную реакцию с точки зрения представлений об окислительно-восстановительных процессах.
-разложение аммиака при нагревании
2NH3 N2 + 3H2
Учащиеся рассматривают данную реакцию
с точки зрения представлений об окислительно-восстановительных процессах.
4.Получение аммиака и применение учащиеся рассматривают самостоятельно, пользуясь учебником, с.85-86.
Выписывают уравнения реакций получения аммиака в промышленности и лаборатории, условия протекания данных реакций. Рассматривают применение аммиака по рис.21, с.86.
5. Этап первичной проверки понимания изученного материала
Из предложенных ответов выберите один вариант, который считаете правильным.
Молекула аммиака содержит общих электронных пар:
а) одну; б) две;
в) три; г) пять.
Раствор аммиака в воде окрашивает фенолфталеин в такой цвет:
а) желтый; б) синий;
в) красный; г) малиновый.
Валентность азота в молекуле аммиака:
а) V; б) III;
в) II; г) IV.
Нашатырный спирт — это:
а) раствор аммиака в воде;
б) раствор аммиака в спирте; в) хлорид аммония;
г) медицинский спирт.
Какое вещество является восстановителем в реакции
NH3 O2 N2 H2O?
а) Аммиак; б) кислород;
в) азот; г) вода.
Аммиак не взаимодействует: а) с серной кислотой;
б) с соляной кислотой;
в) с гидроксидом натрия; г) с водой.
Установите соответствие.
|
Свойства азота | Химические уравнения реакций |
| 1. Реакции, связанные с изменением степени окисления азота | а) б) | NH3 H2O NH4OH 2NH3 N2 3H2 |
| в)
г) | 4NH3 3O2 2N2 6H2O NH3 HCl NH4Cl |
| 2. Реакции, связанные с образованием ковалентной связи по донорно- акцепторному механизму |
Аммиак взаимодействует с кислородом без катализатора с образованием:
а) азота;
б) оксида азота(II);
в) оксида азота(III);
г) азотной кислоты.
6. Этап информирования о домашнем задании
7.Этап подведения итогов урока
Литература
Химия. Уроки в 9 классе : пособие для учителя / Н. Н. Гара. — 2-е изд., перераб. — М.: Просвещение, 2015. — 128 с.
Химия. 9 класс: учебник для общеобразовательных организаций/ Г.Е Рудзитис, Ф.Г Фельдман.- 4-е изд. - М.: Просвещение, 2016.-208с.
Приложения
Слайд 1.


Слайд 2.

Слайд 3.
Опыт: “Получение аммиака”
Опыт: “Горение аммиака”
Видео - Эксперимент: "Окисление аммиака в присутствии оксида хрома"
Анимация: “Донорно-акцепторнорный механизм”
Видео - Эксперимент: “Качественная реакция на аммиак”
Видео - Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео - Эксперимент: “Взаимодействие аммиака с концентрированными кислотами”
Видео - Эксперимент: "Фонтан"
Видео - Эксперимент: "Растворение аммиака в воде"
Опыт: “Разложение карбоната аммония”
Опыт: “Качественная реакция на ион аммония”
Опыт:“Разложение дихромата аммония”





 Слайд 1.
Слайд 1. Слайд 2.
Слайд 2.