10 класс.
Тема 1. Теория строения органических соединений
Дата
Урок 2.
Теория строения органических соединений А.М. Бутлерова.
Явление изомерии
Цели урока:
1. сформировать представления об основных положениях теории строения органических соединений А.М. Бутлерова.
2. совершенствовать умения в мыслительной и исследовательской деятельности.
3. Сформировать представление об изомерии и изомерах.
Ход урока.
Организационный момент.
Изучение нового материала.
В середине ХΙХ столетия органическая химия накопила огромный экспериментальный материал, представляющий собой хаотичное нагромождение различных фактов, требующих объяснения и систематизации. Творцом новой фундаментальной теории-теории химического строения органических соединений стал наш соотечественник А. М. Бутлеров. Много трудностей пришлось преодолеть Бутлерову, прежде чем выйти на дорогу, ставшую главным путем органической химии. Под химическим строением понимают порядок соединения атомов в молекуле согласно их валентности.
Давайте с вами запишем основные положения теории:
1. Атомы в молекуле располагаются в определенной последовательности согласно их валентности. Валентность атома углерода в органических соединениях равна четырем.
2. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле (явление изомерии).
3. По свойствам данного вещества можно определить строение его молекул, а по строению – предвидеть свойства.
4. Изучение свойств веществ позволяет определить их химическое строение.
Данная теория стала научным фундаментом органической химии и ускорила её развитие. Опираясь на положения теории, А.М. Бутлеров описал и объяснил явление изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Что же такое изомерия?
Явление изомерии было известно с 1823 года. Берцелиус (1830 год) предложил назвать изомерами вещества, имеющие одинаковый качественный и количественный состав, но обладающие различным строением и свойствами. В 1861 году загадка изомерии была разгадана.
Изомерия – это явление существования разных веществ – изомеров.
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но обладающие различным строением и свойствами.
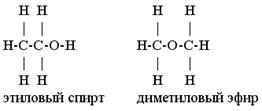
Например, молекулярной формуле C2H6O соответствуют два вещества с разными структурными формулами – этиловый спирт и диметиловый эфир.Этиловый спирт – жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,50С. При тех же условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -230С. Эти вещества отличаются своим строением – разным веществам соответствует одинаковая молекулярная формула.
Типы изомерии
Существуют разные типы изомерии.
2. Межклассовая изомерия
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир – структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой. Рис. 1.
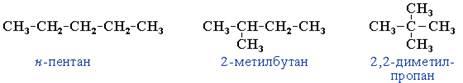
3. Изомерия по углеродному скелету
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C5H12 соответствуют три разных углеводорода. Это изомерия углеродного скелета. Рис. 2.
4. Изомерия положения
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения.


5. Пространственная изомерия
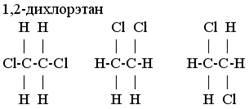
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4
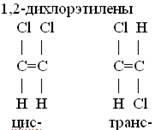
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах – по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя.
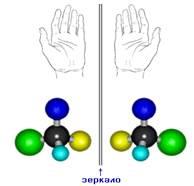
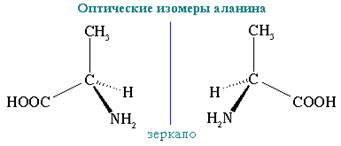
6. Оптическая изомерия
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру – тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия. Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью – от греческого сhier – «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
Оптическая изомерия называется также энантиомерией (от греческого enantios – «противоположный» и meros – «часть»), а оптические изомеры – энантиомерами. Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d-, или (+)-изомер, – вправо, l-, или (–)-изомер, – влево. Смесь равных количеств энантиомеров, называемая рацематом, оптически недеятельна и обозначается символом d,l- или (±).
Домашнее задание: