
Типы кристаллических решёток
Выполнила
Ученица 11 «Б» класса
Гладинова Анастасия

ЗАДАЧИ УРОКА:
1. Сформировать понятие о кристаллическом и аморфном состоянии твердых тел
2.Дать характеристику основных типов кристаллических решёток
3.Установить зависимость физических свойств вещества от характера химической связи и типа кристаллической решётки

Твердое вещество
Кристаллическое
Аморфное
смола
стекло
пластилин
воск
пластмассы
хлорид натрия
графит металлы

Особенности кристаллических веществ
- Строгое расположение частиц, образующих кристаллическую решётку
- Строго определенные Т пл и Т кип
Узлы кристаллической
решётки

Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
Узлы кристаллической
решетки
Особенности аморфных веществ
- Нет строгого расположения частиц, нет кристаллической решётки.
- Нет строго определенных Т пл и Т кип

Типы кристаллических решёток
Кристаллические решётки
Молекулярная
Атомная
Металлическая
Ионная
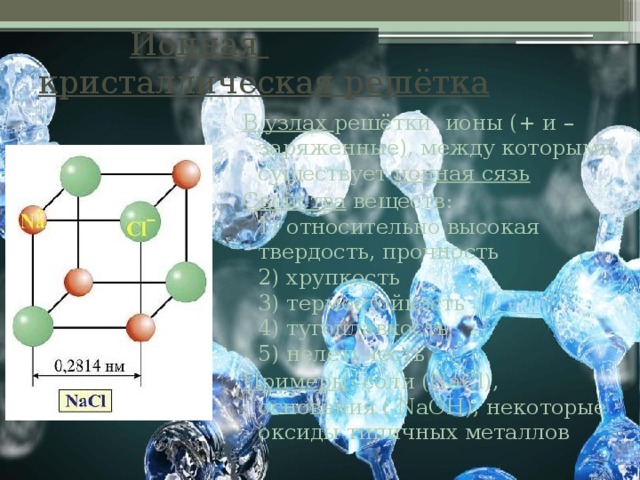
Ионная кристаллическая решётка
В узлах решётки ионы (+ и – заряженные), между которыми существует ионная сязь
Свойства веществ: 1) относительно высокая твердость, прочность 2) хрупкость 3) термостойкость 4) тугоплавкость 5) нелетучесть
Примеры : соли (NaCl), основания ( NaOH), некоторые оксиды типичных металлов

Атомная кристаллическая решётка
В узлах решётки отдельные атомы.
Химическая связь ковалентная Свойства веществ: 1) высокая твердость, прочность 2) высокая Тпл. 3) тугоплавкость
4) практически нерастворимы 5) нелетучесть
Примеры : углерод в форме алмаза, графита; бор и др.
алмаз
графит

Металлическая кристаллическая решётка
В узлах решётки атомы и ионы (+)
Химическая связь металлическая
Свойства веществ: 1) металлический блеск 2 ) тепло- и электропроводность 3) ковкость и пластичность
4) непрозрачность
Примеры : Все металлы (Na, Ca, Fe…, кроме Hg), сплавы и т.д.

Разновидности металлических решёток
в
а
б
а)кубическая объемно-центрированная
б)кубическая гранецентрированная
в)гексагональная плотноупакованная

Молекулярная кристаллическая решетка
В узлах решетки - молекулы
Химическая связь
Ковалентная неполярная
Ковалентная полярная
(между частицами в узлах решётки действуют только слабые межмолекулярные силы)
( между молекулами в узлах действуют слабые силы межмолекулярного притяжения)
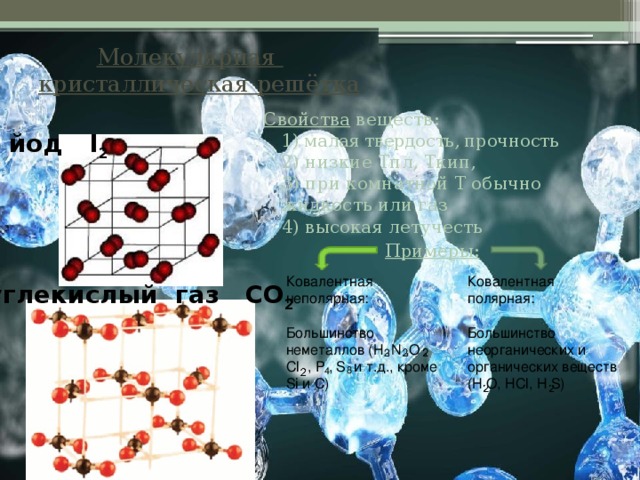
Молекулярная кристаллическая решётка
Свойства веществ: 1) малая твердость, прочность 2) низкие Тпл, Ткип, 3) при комнатной Т обычно жидкость или газ 4) высокая летучесть
Примеры:
йод I 2
Ковалентная
Ковалентная
неполярная:
полярная:
Большинство неметаллов (H ,N ,O , Cl , P , S и т.д., кроме Si и C)
Большинство неорганических и органических веществ (H O, HCl, H S)
углекислый газ СО 2
2
8
4
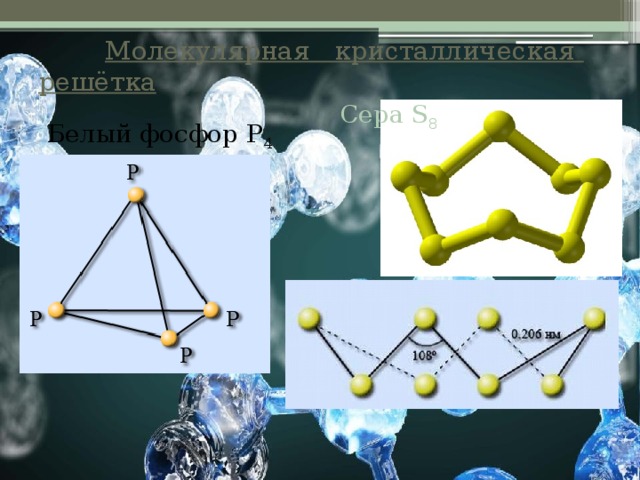
Молекулярная кристаллическая решётка
Сера S 8
Белый фосфор Р 4
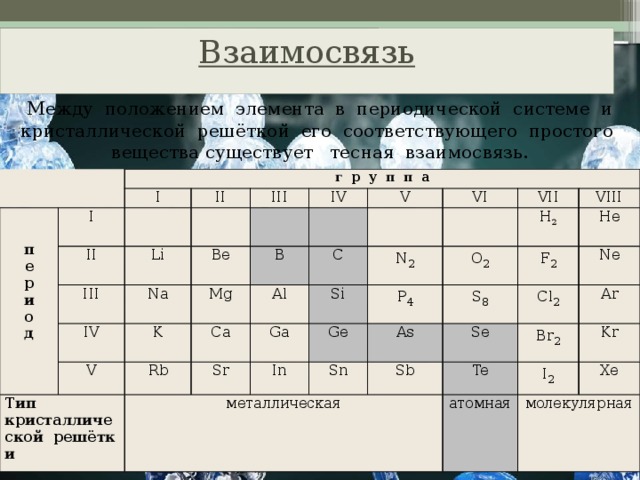
Взаимосвязь
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
г р у п п а
I
I
II
II
п
III
Li
III
е
Be
IV
IV
р
Na
Тип
V
K
V
B
и
Mg
VI
Ca
C
кристаллической решётки
Al
Rb
о
VII
металлическая
Sr
N 2
Si
Ga
д
Ge
O 2
VIII
H 2
P 4
In
Sn
He
S 8
As
F 2
Se
Ne
Cl 2
Sb
Ar
Te
Br 2
Kr
атомная
I 2
Xe
молекулярная
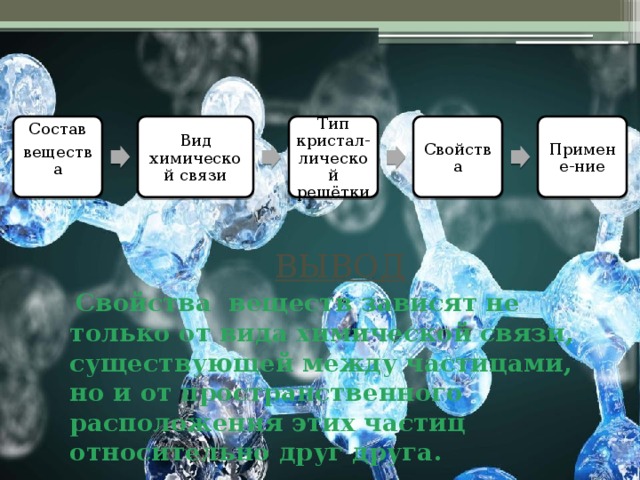
Состав
Вид химической связи
Тип кристал-лической решётки
Свойства
Примене-ние
вещества
ВЫВОД
Свойства веществ зависят не только от вида химической связи, существующей между частицами, но и от пространственного расположения этих частиц относительно друг друга.
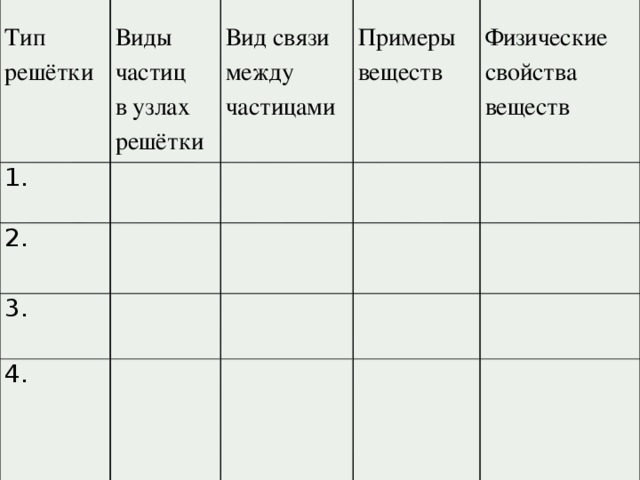
Тип решётки
Виды частиц
1.
Вид связи между частицами
2.
в узлах решётки
Примеры веществ
3.
Физические свойства веществ
4.
Тип решётки
Ионная
Виды частиц
Вид связи между частицами
Атомная
в узлах решётки
Ионы
Атомы
Примеры веществ
Ионная – связь прочная
Молекулярная
Металлическая
1. Ковалентная не полярная – связь очень прочная 2. Ковалентная полярная – связь очень прочная
Физические свойства веществ
Соли, галогениды (IA, IIA),оксиды и гидроксиды типичных металлов
Молекулы
Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток
Простые веществ а : алмаз (C), графит (C) , бор (B), кремний (Si). Сложные вещества : оксид алюминия (Al 2 O 3 ), оксид кремния (IV) – SiO 2
Между молекулами – слабые силы межмолекулярного притяжения, а вот внутри молекул – прочная ковалентная связь
Атом-ионы
Очень твердые, очень тугоплавкие, прочные, нелетучие, не растворимы в воде
Металлическая – разной прочности
Твердые вещества при особых условиях, которые при обычных – газы или жидкости (О 2 , Н 2 , Cl 2 , N 2 , Br 2 , H 2 O, CO 2 , HCl); сера, белый фос фор, йод; органические вещества
Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны


































